题目内容
【题目】某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1。下列有关叙述中错误的是
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
【答案】C
【解析】设X的气态氢化物的化学式为![]() ,高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1,则
,高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1,则![]() ,若m=2,x=32,X元素为S;S2-电子排布式是1s22s22p63s23p6,故A正确;硫酸的酸性比砷酸强,故B正确;S的最高价氧化物是SO3,S的质量分数为
,若m=2,x=32,X元素为S;S2-电子排布式是1s22s22p63s23p6,故A正确;硫酸的酸性比砷酸强,故B正确;S的最高价氧化物是SO3,S的质量分数为![]() 40%,故C错误;H2S水溶液呈酸性,故D正确。
40%,故C错误;H2S水溶液呈酸性,故D正确。

练习册系列答案
相关题目
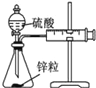
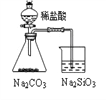
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性 C>Si |
A. A B. B C. C D. D