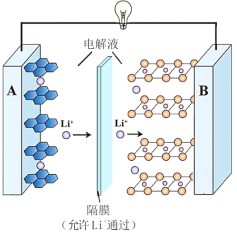
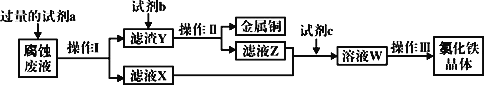
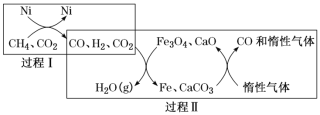
题目内容
【题目】某温度下,向一定体积0.1mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH [pOH=-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是
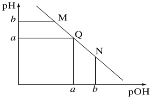
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(H+)=c(OH-),pH =7
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,![]() 变小
变小
【答案】B
【解析】
碱溶液中pOH越大、pH越小,说明溶液中氢氧根离子浓度越小,氢离子浓度越大,碱性越弱、酸性越强,随着盐酸的加入,发生中和反应,溶液氢氧根离子的浓度逐渐减小,则溶液pH逐渐减小,pOH逐渐增大,结合弱电解质的电离解答该题。
A、由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故A正确;
B; Q点时pH= pOH,说明c(OH-)=c(H+),溶液呈中性,但是并不一定为常温,pH不一定等于7,故B错误;
C.、M点溶液中主要溶质为一水合氨,为弱电解质,在溶液中部分电离,溶液中离子浓度较小,Q点溶液中主要为氯化铵,为强电解质,溶液中离子浓度较多,所以M点的导电能力小于Q点,故C正确;
D、N点溶液加水稀释,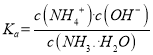 ,温度不变,Ka不变,加水稀释氢离子浓度减小,c(OH-)增大,所以
,温度不变,Ka不变,加水稀释氢离子浓度减小,c(OH-)增大,所以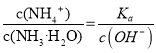 变小,故D正确;
变小,故D正确;
故选B。

【题目】水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 20 | 30 | 40 | 从40℃冷却到20℃ | 沸水浴后冷却到20℃ |
颜色变化 | 红色略加深 | 红色接近① | 红色比③加深较多 | ||
pH | 8.31 | 8.29 | 8.26 | 8.31 | 9.20 |
下列说法不正确的是( )
A.NaHCO3溶液显碱性的原因:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:___________________________________________。
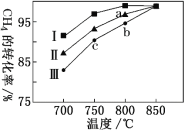
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
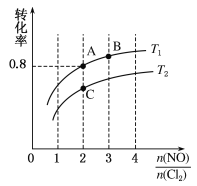
(1)图中T1、T2的关系为T1________T2(填“>”“<”或“=”)。
(2)图中纵坐标为物质________的转化率,理由为_________________________________。
(3)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”“B”或“C”)。
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=_________。B点的平衡常数为________。
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)_____υ(逆) (填“<”“>”或“=”),理由为________________________________