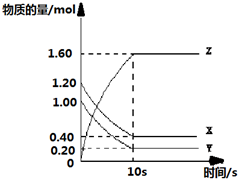
题目内容
9.下列实验装置能达到实验目的是( )| A. | 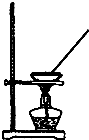 如图所示装置获得碳酸氢钠固体 | B. | 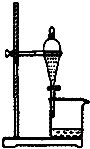 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 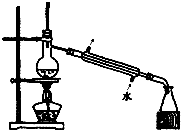 如图所示装置制取少量蒸馏水 | D. | 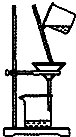 如图所示装置提纯氢氧化铁胶体 |
分析 A.碳酸氢钠不稳定受热易分解;
B.分液漏斗分离的互不相溶的两种液体;
C.实验室制取蒸馏水可以通过加热蒸馏的方法;
D.胶体与溶液都能透过滤纸.
解答 解:A.碳酸氢钠不稳定受热易分解,加热蒸发得不到碳酸氢钠,故A错误;
B.乙酸与乙酸乙酯相互溶解,不分层,不能用分液法分离,故B错误;
C.实验室制取蒸馏水可以通过加热蒸馏的方法,故C正确;
D.胶体与溶液都能透过滤纸,提纯氢氧化铁胶体应选择半透膜,用渗析法,故D错误;
故选:C.
点评 本题考查了基本实验操作,熟悉蒸发结晶、分液、蒸馏、过滤与渗析的原理是解题关键,题目难度不大.

练习册系列答案
相关题目
6.对于2(g)A+B(g)?2C(g),△H<0,当温度升高时,平衡向逆反应方向移动,其原因是( )
| A. | 正反应速率增大,逆反应速率减小 | |
| B. | 逆反应速率增大,正反应速率减小 | |
| C. | 正、逆反应速率均增大,但是逆反应速率增大的程度大于正反应速率增大的程度 | |
| D. | 正、逆反应速率均增大,而且增大的程度一样 |
17.下列事实能说明甲酸(HCOOH)是弱酸的是( )
| A. | 甲酸能与水以任意比互溶 | |
| B. | 0.1mol/L的甲酸钠溶液的pH约为9 | |
| C. | 0.1mol/L的甲酸溶液的pH约为4.8 | |
| D. | 10mL0.1mol/L的甲酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
4.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2:1时,还原产物可能是( )
| A. | N2O | B. | NO | C. | NO2 | D. | N2 |
14.下列既含离子键又含有极性键的物质是( )
| A. | NaCl | B. | NaOH | C. | H2 | D. | HCl |
18.制取CH3CH2Cl,采用的最佳方法是( )
| A. | 乙烷和氯气取代反应 | B. | 乙烯和氯气加成反应 | ||
| C. | 乙烯和HCl加成反应 | D. | 乙烷和HCl作用 |
19.下列说法不正确的是( )
| A. | CS2 与CO2均为直线形非极性分子 | |
| B. | 熔点:SiCl4<MgCl2<SiO2 | |
| C. | 水加热到很高的温度都难以分解,是因为水中含有氢键 | |
| D. | 断裂化学键的过程不一定发生化学变化 |
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下: