题目内容
17.下列事实能说明甲酸(HCOOH)是弱酸的是( )| A. | 甲酸能与水以任意比互溶 | |
| B. | 0.1mol/L的甲酸钠溶液的pH约为9 | |
| C. | 0.1mol/L的甲酸溶液的pH约为4.8 | |
| D. | 10mL0.1mol/L的甲酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
分析 A.电解质的溶解性大小与强弱电解质无关;
B.甲酸钠溶液呈碱性,证明甲酸钠为强碱弱酸盐;
C.0.1mol/L甲酸溶液的pH约为4.8,说明甲酸部分电离,证明了甲酸为弱电解质;
D.二者恰好反应,只能证明甲酸是一元酸,不能证明甲酸是弱电解质.
解答 解:A.甲酸能与水以任意比互溶,说明甲酸溶解性较大,不能说明甲酸部分电离,则不能证明甲酸是弱电解质,故A错误;
B.0.1mol/L的甲酸钠溶液的pH约为9,证明甲酸钠为强碱弱酸盐,从而证明甲酸为弱酸,故B正确;
C.0.1mol/L甲酸溶液的pH约为4.8,甲酸中氢离子浓度小于0.1mol/L,说明甲酸部分电离,证明了甲酸是弱电解质,故C正确;
D.10mL 0.1mol/L甲酸恰好与10mL 0.1mol/LNaOH溶液完全反应,证明甲酸是一元酸,不能说明甲酸部分电离,则不能证明甲酸是弱电解质,故D错误;
故选BC.
点评 本题考查弱电解质的判断,题目难度不大,明确强弱电解质的本质区别为“在水溶液中能否完全电离”,电解质强弱只根据电离程度大小判断,不能根据其溶解性强弱判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
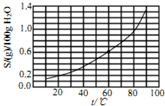

| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
14.下列反应中,氧化反应与还原反应在同一元素中进行的是( )
| A. | 2FeC12+C12=2FeC13 | B. | Fe+CuSO4=Cu+FeSO4 | ||
| C. | C12+2NaOH=NaC1+NaC1O+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
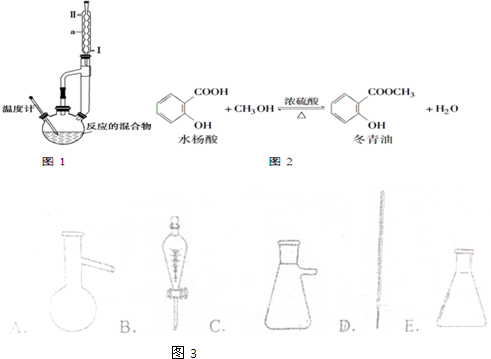
5.冬青油是一种无色液体,某实验小组利用如图1所示的装置制备冬青油.化学反应原理和实验装置如图2所示:
产物的有关数据如表所示:
实验步骤如下所示:
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到图3中的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.

产物的有关数据如表所示:
| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀.
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h.
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL 5%碳酸氢钠溶液和30mL水洗涤.
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙.
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g.
请回答下列问题:
(1)本实验中浓硫酸的作用是催化剂、吸水剂.
(2)装置中仪器a的名称是冷凝管,进水口为Ⅱ(填“Ⅰ”或“Ⅱ”).
(3)②中的沸石的作用防止瀑沸,实验过程中发现未加沸石,因采取的操作是B(写序号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)用碳酸氢钠溶液洗涤的目的是将冬青油中的甲醇、水杨酸溶解,便于液体分层;用水洗涤时,产品在下(填“上”或“下”)层.
(5)加入无水氯化钙的目的是除去粗产品中的水分.
(6)粗产品蒸馏过程中,不可能用到图3中的仪器有B.(填正确答案序号)
(7)本次实验中冬青油的产率为89.5%.
12.0.2mol•L-1的醋酸溶液中,各种离子浓度的关系正确的是( )
| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
2.盛有O2和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.则原混合气体中O2和NO2的体积比是( )
| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 1:2 |
9.下列实验装置能达到实验目的是( )
| A. | 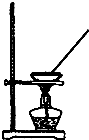 如图所示装置获得碳酸氢钠固体 | B. | 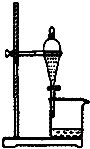 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 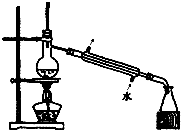 如图所示装置制取少量蒸馏水 | D. | 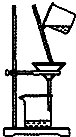 如图所示装置提纯氢氧化铁胶体 |
6.下列关于平衡常数的说法正确的是( )
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
7.下列反应中,能够说明乙烯分子具有不饱和键的是( )
| A. | 加成反应 | B. | 取代反应 | C. | 燃烧 | D. | 氧化反应 |