题目内容
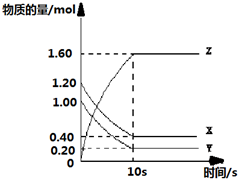
1.(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则:①反应的化学方程式为X+Y?2Z.
②0~10s内,用Z表示的化学反应速率0.08mol•L-1•s-1.
③X的转化率为0.667或66.7%.
(2)向一恒容密闭容器中充入2mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2$\stackrel{催化剂}{?}$2SO3,下列有关说法不正确的是AC
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当O2的浓度不变时,反应达到平衡状态
C. 当单位时间生成a mol O2,同时生成2a mol SO2时,反应达到平衡状态
D. SO2和O2 的转化率相等.
分析 (1)①根据图知,X、Y是反应物,Z是生成物,反应达到平衡状态时,参加反应的△n(X)=(1.20-0.40)mol=0.80mol,△n(Y)=(1.00-0.20)mol=0.80mol,△n(Z)=(1.60-0)mol=1.60mol,
同一反应中同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,据此书写方程式;
②~10s内,用Z表示的化学反应速率=$\frac{\frac{△n}{V}}{△t}$;
③转化率=$\frac{参加反应的物质的量}{反应初始物质的量}×100%$;
(2)当可逆反应达到平衡状态时,正逆反应速率相等,且反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变.
解答 解:(1)①根据图知,X、Y是反应物,Z是生成物,反应达到平衡状态时,参加反应的△n(X)=(1.20-0.40)mol=0.80mol,△n(Y)=(1.00-0.20)mol=0.80mol,△n(Z)=(1.60-0)mol=1.60mol,
同一反应中同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比=0.80mol:0.80mol:1.60mol=1:1:2,所以该反应方程式为X+Y?2Z,故答案为:X+Y?2Z;
②~10s内,用Z表示的化学反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.60mol}{2L}}{10s}$=0.08 mol•L-1•s-1,故答案为:0.08 mol•L-1•s-1;
③转化率=$\frac{参加反应的物质的量}{反应初始物质的量}×100%$=$\frac{0.80mol}{1.20mol}×100%$=0.667或66.7%,
故答案为:0.667或66.7%;
(2)A.达到化学平衡时,正反应和逆反应的速率相等但不为零,故错误;
B.当O2的浓度不变时,正逆反应速率相等,所以反应达到平衡状态,故正确;
C.无论反应是否达到平衡状态,都存在单位时间生成a mol O2同时生成2a mol SO2时,所以不能据此判断平衡状态,故错误;
D.SO2和O2的物质的量之比等于其计量数之比,所以二者的转化率相等,故正确;
故选AC.
点评 本题考查图象分析和平衡状态的判断等知识点,侧重考查学生分析、计算及判断能力,知道同一反应中参加反应物质的物质的量之比与计量数的关系,注意(2)中平衡状态时正逆反应速率不是0,为易错点.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 分液时,水溶液一定从下口放出 | |
| B. | 蒸馏时,如果温度计水银球下端高于蒸馏烧瓶支管口上沿,收集到的馏分沸点偏高 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 | |
| D. | 量取20.0mL浓硫酸时,俯视读数,所取液体体积偏大 |
| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
| A. | 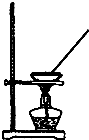 如图所示装置获得碳酸氢钠固体 | B. | 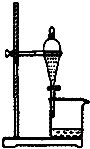 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 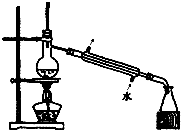 如图所示装置制取少量蒸馏水 | D. | 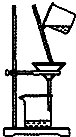 如图所示装置提纯氢氧化铁胶体 |
| A. | 一氯甲烷的结构式CH3Cl | B. | 苯的分子式C6H6 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 氮气的电子式 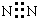 |
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- | |
| B. | 向1 mo1•L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| C. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol•L-1,c(CO32-)=0.0001 mol•L-1,此时Mg2+和CO32-不能共存 |
| A. | 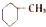 苯的同系物 | B. | 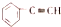 芳香烃 | C. |  卤代烃 | D. |  酯 |
| A. | 光催化还原水制氢气比电解水制取氢更节能环保、更经济 | |
| B. | 氯气加压液化可用钢瓶贮存运输 | |
| C. | 向汽油中添加甲醇后,可减少汽车尾气的排放 | |
| D. | 明矾既可做净水剂也可作消毒剂 |