题目内容
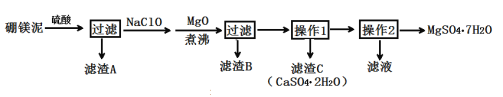
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。
【答案】11.5mol/L SiO2、MnO2 防止生成Al(OH)3和Fe(OH)3胶体,使之转化为沉淀而被分离 ClO-+2Fe2++2H+=Cl-+2Fe3++H2O 析出MgSO4·7H2O晶体 蒸发浓缩 冷却结晶 不能 加入MgO的量未知
【解析】
硼镁泥用足量硫酸酸浸溶解,得到含有Mg2+、Ca2+、Fe2+、Fe3+、Al3+以及SO42-的酸性溶液,由于MnO2、SiO2不与硫酸反应,硫酸钙属于微溶物,则过滤后滤渣A主要为MnO2、SiO2,还含有少量CaSO4·2H2O,向滤液中加入NaClO将Fe2+氧化为Fe3+,加入MgO调节溶液pH值并加热,使Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,则滤渣B主要为氢氧化铁、氢氧化铝,根据溶解度表,CaSO4的溶解度基本不受温度影响,MgSO4·7H2O受温度影响较大,温度越高溶解度越大,对滤液进行蒸发浓缩、趁热过滤,得到CaSO4·2H2O,则滤渣C主要为CaSO4·2H2O,再次对滤液蒸发浓缩、冷却结晶,过滤洗涤,得到七水硫酸镁(MgSO4·7H2O),据此分析解答。
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度=![]() =
=![]() =11.5mol/L;
=11.5mol/L;
(2)根据分析,滤渣A中除含少量CaSO4·2H2O外,还有MnO2、SiO2;
(3)加入MgO的目的是沉淀Fe3+、Al3+,但Fe3+、Al3+易发生水解生成胶体,因此加热煮沸的目的是防止生成Al(OH)3和Fe(OH)3胶体,使之转化为沉淀而被分离;
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。向滤液中加入NaClO将Fe2+氧化为Fe3+,则加入NaClO发生氧化还原反应的离子方程式为ClO-+2Fe2++2H+=Cl-+2Fe3++H2O;
(5)根据溶解度表,CaSO4的溶解度基本不受温度影响,MgSO4·7H2O受温度影响较大,温度越高溶解度越大,流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止析出MgSO4·7H2O晶体;
(6)结合溶解度表数据和(5)分析,获取MgSO4·7H2O的操作2为:蒸发浓缩、冷却结晶,过滤洗涤;
(7)在制取七水硫酸镁流程中,向体系内加入了氧化镁调节pH值沉淀Fe3+、Al3+,引入了镁元素,且未告知氧化镁加入的量,制取的七水硫酸镁的镁元素不仅来自硼镁泥,还来自引入的氧化镁,因此不能根据上述两个条件来计算硼镁泥中镁元素的含量。

 愉快的寒假南京出版社系列答案
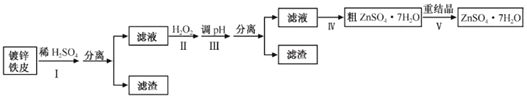
愉快的寒假南京出版社系列答案【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
相关信息如下:
①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
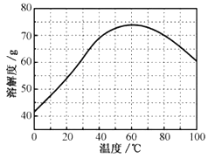
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是__。
②步骤Ⅰ可用于判断镀锌层完全反应的实验现象是__。
(2)步骤Ⅱ须加入过量H2O2理由是__。
(3)步骤Ⅲ,合适的pH范围是__。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜,停止加热;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。
请给出上述操作的正确顺序__。(操作可重复使用)
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO47H2O晶体颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择__方式进行冷却结晶。
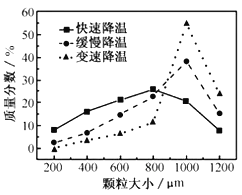
A.快速降温 B.缓慢降温 C.变速降温
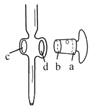
(6)①ZnSO47H2O产品的纯度可用配位滴定法测定。
下列关于滴定分析,正确的是__。
A.图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图中滴定终点是的读数是___mL。

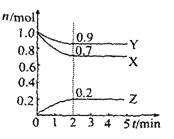
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
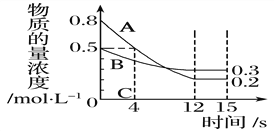
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化