题目内容
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
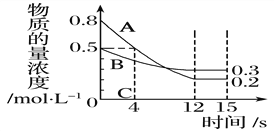
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
【答案】 3A(g)+B(g) ![]() 2C(g) 乙>甲>丙 3~4min 因该反应是放热反应,此时温度高,温度对反应速率占主导作用 AC BC
2C(g) 乙>甲>丙 3~4min 因该反应是放热反应,此时温度高,温度对反应速率占主导作用 AC BC
【解析】(1)经测定前4s内v(C)=0.05 mol·L-1·s-1,生成C是0.05 mol·L-1·s-1×4s=0.2mol/L,此时消耗A是0.8ml/L-0.5mol/L=0.3mol/L,则a:c=3:2;平衡时消耗A与B分别是0.6mol/L,0.2mol/L,则a:b=3:1,所以该反应的化学方程式为3A(g)+B(g)![]() 2C(g);(2)如果都用物质A表示反应速率,则根据反应速率之比是相应的化学计量数之比可知分别是0.3 mol·L-1·s-1、0.36 mol·L-1·s-1、0.24 mol·L-1·s-1,所以甲、乙、丙三个容器中反应速率由快到慢的顺序为乙>甲>丙。(3)0~1、1~2、2~3、3~4、4~5、5~6 min中生成的氢气体积分别是(mL)50、70、104、168、80、30,因此反应速率最大3~4min,这是由于该反应是放热反应,此时温度高,温度对反应速率占主导作用;(4)A.CH3COONa与氢离子反应生成弱酸醋酸,氢离子浓度降低,反应速率减小,随着反应的进行,氢离子又逐渐电离出来,所以生成的氢气体积几乎不变,A错误;B.加入NaNO3溶液,在酸性溶液中硝酸根具有强氧化性,与金属反应不能得到氢气,B错误;C.KCl溶液相当于稀释,氢离子浓度降低,反应速率减小,且生成的氢气体积不变,C正确;D.Na2CO3溶液消耗氢离子产生二氧化碳,最终生成的氢气体积减少,D错误,答案选AC;(5)A.单位时间内生成n mol H2的同时,生成n mol HI不满足反应速率之比是相应的化学计量数之比,没有达到平衡状态,A错误;B.一个H-H键断裂的同时有两个H-I键断裂满足反应速率之比是相应的化学计量数之比,达到平衡状态,B正确;C.温度和体积一定时,混合气体颜色不再变化说明单质碘的浓度不再发生变化,达到平衡状态,C正确;D.反应速率v(H2)=v(I2)=
2C(g);(2)如果都用物质A表示反应速率,则根据反应速率之比是相应的化学计量数之比可知分别是0.3 mol·L-1·s-1、0.36 mol·L-1·s-1、0.24 mol·L-1·s-1,所以甲、乙、丙三个容器中反应速率由快到慢的顺序为乙>甲>丙。(3)0~1、1~2、2~3、3~4、4~5、5~6 min中生成的氢气体积分别是(mL)50、70、104、168、80、30,因此反应速率最大3~4min,这是由于该反应是放热反应,此时温度高,温度对反应速率占主导作用;(4)A.CH3COONa与氢离子反应生成弱酸醋酸,氢离子浓度降低,反应速率减小,随着反应的进行,氢离子又逐渐电离出来,所以生成的氢气体积几乎不变,A错误;B.加入NaNO3溶液,在酸性溶液中硝酸根具有强氧化性,与金属反应不能得到氢气,B错误;C.KCl溶液相当于稀释,氢离子浓度降低,反应速率减小,且生成的氢气体积不变,C正确;D.Na2CO3溶液消耗氢离子产生二氧化碳,最终生成的氢气体积减少,D错误,答案选AC;(5)A.单位时间内生成n mol H2的同时,生成n mol HI不满足反应速率之比是相应的化学计量数之比,没有达到平衡状态,A错误;B.一个H-H键断裂的同时有两个H-I键断裂满足反应速率之比是相应的化学计量数之比,达到平衡状态,B正确;C.温度和体积一定时,混合气体颜色不再变化说明单质碘的浓度不再发生变化,达到平衡状态,C正确;D.反应速率v(H2)=v(I2)=![]() v(HI)没有指明反应速率的方向,不能说明反应达到平衡状态,D错误;E.反应前后体积不变,温度和体积一定时,容器内压强始终不变,不能说明反应达到平衡状态,E错误;F.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以温度和体积一定时,混合气体的密度不再变化,不能说明反应达到平衡状态,F错误;答案选BC。
v(HI)没有指明反应速率的方向,不能说明反应达到平衡状态,D错误;E.反应前后体积不变,温度和体积一定时,容器内压强始终不变,不能说明反应达到平衡状态,E错误;F.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以温度和体积一定时,混合气体的密度不再变化,不能说明反应达到平衡状态,F错误;答案选BC。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案