题目内容
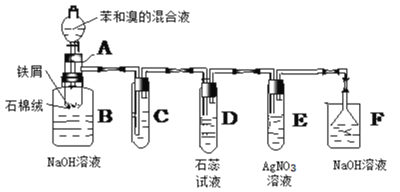
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。

(1)实验室制取氨气选用图中a发生装置进行实验,反应的化学方程式为___________。实验室制取氨气选用图中b发生装置进行实验,反应的化学方程式为_________。

(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___________
(5)F装置中倒置漏斗的作用__________
(6)工业上硝酸的制备和自然界中的硝酸的生成既有相同的地方,又有区别。路线Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径:

写出①③步变化的化学方程式:
①____________;
③____________;
(7)将11.2 g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的气体x(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是______________。
A.0.3 mol NO2和0.3 mol NO B.0.2 mol NO2和0.1 mol N2O4
C.0.6 mol NO D.0.1molNO、0.2 mol NO2和0.05 mol N2O4
【答案】2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O NH3 H2O
CaCl2 + 2NH3↑+2H2O NH3 H2O![]() NH3↑+H2O 碱石灰 D 产生白烟 防止倒吸 4NH3+5O2
NH3↑+H2O 碱石灰 D 产生白烟 防止倒吸 4NH3+5O2 4NO+6H2O 3NO2+H2O=2HNO3+NO D
4NO+6H2O 3NO2+H2O=2HNO3+NO D
【解析】
(6)结合氨气的性质和物质的转化关系,可知反应①为NH3被氧气氧化生成NO的过程,反应②为NO与O2反应生成NO2的过程,反应③为NO2与水反应生成硝酸的过程。
(7)分析反应过程,Cu、Mg失去电子,化合价升高,变成Cu(OH)2、Mg(OH)2。根据得失电子守恒,判断![]() 的还原产物。
的还原产物。
(1)分析a装置,为固体加热反应制氨气,可知应为NH4Cl和Ca(OH)2反应制氨气,反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;若用装置b制取氨气,反应物状态为液态,反应条件为加热,可知反应方程式应为:NH3H2O
CaCl2+2NH3↑+2H2O;若用装置b制取氨气,反应物状态为液态,反应条件为加热,可知反应方程式应为:NH3H2O![]() NH3↑+H2O;
NH3↑+H2O;
(2)氨气为碱性气体,会与浓硫酸反应,故不能用浓硫酸进行干燥,干燥剂应选择碱石灰;
(3)氨气为碱性气体,可使湿润的红色石蕊试纸变蓝,故气体通过C、D装置时,试纸颜色会发生变化的是D;
(4)氨气会与HCl反应生成氯化铵,可观察到装置E中有白烟产生;
(5)氨气极易溶于水,漏斗的作用是防止倒吸;
(6)由含氮的化合物之间的转化关系,可知,反应①的反应方程式为:4NH3+5O2 4NO+6H2O;反应③的反应方程式为:3NO2+H2O=2HNO3+NO;
4NO+6H2O;反应③的反应方程式为:3NO2+H2O=2HNO3+NO;
(7)根据反应中得失电子守恒进行判断,11.2gMg-Cu混合物反应后变成21.4g Cu(OH)2、Mg(OH)2。则Cu(OH)2、Mg(OH)2中m(OH-)=![]() ,根据电荷守恒可知,11.2gMg-Cu失去电子0.6mol。则
,根据电荷守恒可知,11.2gMg-Cu失去电子0.6mol。则![]() 的还原产物得到的电子也为0.6mol。据此
的还原产物得到的电子也为0.6mol。据此
A.生成0.3mo1NO2和0.3mo1NO,N元素获得电子为![]() ,
,![]() 的还原产物得到的电子不是0.6mol,A项错误;
的还原产物得到的电子不是0.6mol,A项错误;
B.生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为![]() ,
,![]() 的还原产物得到的电子不是0.6mol,B项错误;
的还原产物得到的电子不是0.6mol,B项错误;
C.生成0.6 mol NO,N元素获得电子为![]() ,
,![]()
D.生成0.1molNO、0.2mol NO2和0.05 mol N2O4,N元素获得电子为![]() ,
,![]() 的还原产物得到的电子是0.6mol,根据得失电子数守恒,可知D项正确;
的还原产物得到的电子是0.6mol,根据得失电子数守恒,可知D项正确;
答案选D。

 考前必练系列答案
考前必练系列答案【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
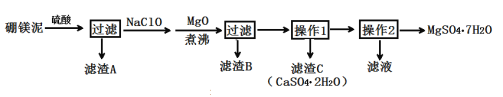
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。