题目内容
11.有v1mL pH=9的氨水(A)和v2mL pH=10的氨水(B),v3mL pH=10的NaOH溶液(C),它们能中和同量的盐酸.以下叙述正确的是( )| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2=v3 | |
| D. | 中和热A=B=C |
分析 氨水为弱碱,同等pH值的氨水溶液与氢氧化钠溶液,氨水的浓度要比氢氧化钠大,据此解答即可.
解答 解:氨水为弱碱,同等pH值的氨水溶液与氢氧化钠溶液,氨水的浓度要比氢氧化钠大,
A、氨水浓度越小,电离程度越大,故A和B能中和同量的盐酸时,消耗A的体积>B的10倍,故A正确;
B、加入少量水稀释,氨水电离程度增大,但是碱性减弱,故氢氧根浓度减小,温度不变,故:$\frac{c(N{H}_{4}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不变,氢氧根浓度减小,故$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大,故B错误;
C、由于氨水是弱碱,故随着反应的进行继续电离出氢氧根,故v2<v3,故C错误;
D、中和热的定义为:稀的强酸与稀的强碱反应生成1mol水放出的热量,由于氨水是弱碱,故电离需要吸热,故反应热ABC不同,故D错误,故选A.
点评 本题主要考查的是弱碱的电离以及影响其电离的因素等,难度较大,注意分析溶液中各种离子的浓度变化是关键.

练习册系列答案
相关题目
1.铜锌合金俗称黄铜.下列不易鉴别黄铜与真金的方法是( )
| A. | 测密度 | B. | 测熔点 | C. | 灼烧 | D. | 看外观 |
19.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间判断空气中的含汞量,其反应为:4CuI+Hg=Cu2Hgl4+2Cu2,下列说法正确的是( )
| A. | 产物Cu2HgI4中,Cu元素的化合价为+2 | |
| B. | 由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-=CuI | |
| C. | 该反应的氧化剂CuI,氧化产物为Cu | |
| D. | 当有2molCuI参与反应时,转移电子为1mol |
6.下列气体除杂所用试剂错误的是(括号内为杂质)( )
| A. | Cl2(HCl):饱和食盐水 | B. | H2(H2S、HCl、H2O):碱石灰 | ||
| C. | SO2(HCl):Na2SO3溶液 | D. | CO2(H2S):CuSO4溶液 |
3.2015年2月,科学家首次观测到化学键的形成.化学键不存在于( )
| A. | 原子与原子之间 | B. | 分子与分子之间 | C. | 离子与离子之间 | D. | 离子与电子之间 |
1.25℃时,0.1mol/L盐酸与0.1mol/L K2CO3溶液等体积混合,下列说法正确的是( )
| A. | 溶液显酸性 | |
| B. | c(H+)+c(K+)=c(OH-)+c(Cl-)+c(HCO3-)+c(CO32-) | |
| C. | c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | c(K+)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |

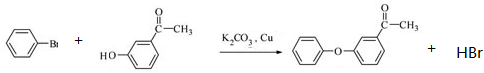 .
. 、
、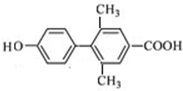 、
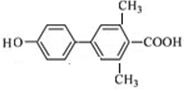
、 、
、 (其中一种).
(其中一种).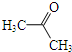 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: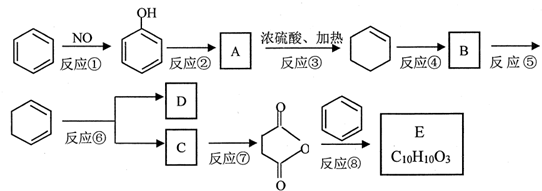
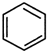 +(CH3CO)2O→
+(CH3CO)2O→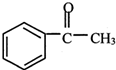 +CH3COOH
+CH3COOH ; B
; B
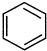 直接制取
直接制取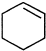 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.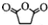 +
+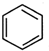 →
→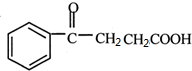 .
.

 也可发生类似反应①的反应,生成化合物Ⅳ:
也可发生类似反应①的反应,生成化合物Ⅳ: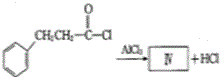
 .
. .
. .
.