题目内容
1.25℃时,0.1mol/L盐酸与0.1mol/L K2CO3溶液等体积混合,下列说法正确的是( )| A. | 溶液显酸性 | |
| B. | c(H+)+c(K+)=c(OH-)+c(Cl-)+c(HCO3-)+c(CO32-) | |
| C. | c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | c(K+)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
分析 25℃时,0.1mol/L盐酸与0.1mol/L K2CO3溶液等体积混合,二者恰好反应生成碳酸氢钾和氯化钾,
A.碳酸氢根离子部分水解,溶液显示碱性;
B.根据混合液中的电荷守恒分析;
C.根据反应后的混合液中的物料守恒分析;
D.碳酸氢根离子部分水解,则c(K+)>c(Cl-)>c(HCO3-).
解答 解:反应后溶质为等浓度的碳酸氢钾和氯化钾,
A.由于碳酸氢根离子部分水解,溶液显示碱性,故A错误;
B.根据溶液中的电荷守恒可得:c(H+)+c(K+)=c(OH-)+c(Cl-)+c(HCO3-)+2c(CO32-),故B错误;
C.根据混合液中的物料守恒可得:1212c(K+)=c(Cl-)=c(CO32-)+c(HCO3-)+c(H2CO3)=0.05mol/L,故C正确;
D.由于碳酸氢根离子部分水解,则c(Cl-)>c(HCO3-),溶液中正确的离子浓度大小为:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
11.有v1mL pH=9的氨水(A)和v2mL pH=10的氨水(B),v3mL pH=10的NaOH溶液(C),它们能中和同量的盐酸.以下叙述正确的是( )
| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中c(NH+4)c(NH3•H2O)都减小 | |
| C. | v2=v3 | |
| D. | 中和热A=B=C |
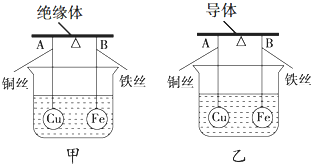
16.请根据短周期元素在元素周期表中的位置,结合所提供的图表回答下列问题:
(1)元素周期表第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,其中A的晶体类型是离子晶体,
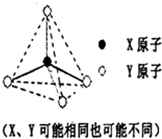
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).

9.下列说法正确的是( )
| A. | 用福尔马林对种子消毒不属于蛋白质变性 | |
| B. | 能用新制的氢氧化铜鉴别果糖与葡萄糖溶液 | |
| C. | 实验证实化合物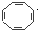 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| D. | 化合物的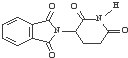 分子式为C13H8O4N2 分子式为C13H8O4N2 |
7.关于“绿色化学”特点概述错误的是( )
| A. | 采用无毒无害的原料,生产有利环保、人体健康、安全的产品 | |
| B. | 在无毒、无害的条件下反应,减少废物向环境排放 | |
| C. | 充分利用能源、资源,提高原子利用率、使原料的原子都成为产品 | |
| D. | 充分利用绿色原料进行化工生产,产出绿颜色产品 |