题目内容
6.下列气体除杂所用试剂错误的是(括号内为杂质)( )| A. | Cl2(HCl):饱和食盐水 | B. | H2(H2S、HCl、H2O):碱石灰 | ||
| C. | SO2(HCl):Na2SO3溶液 | D. | CO2(H2S):CuSO4溶液 |
分析 A.氯气不溶于饱和食盐水;
B.H2S、HCl、H2O都可与碱石灰反应;
C.二者都与Na2SO3溶液反应;
D.H2S与CuSO4反应生成CuS沉淀.
解答 解:A.HCl易溶于水,而氯气不溶于饱和食盐水,可用于除杂,故A正确;
B.H2S、HCl、H2O都可与碱石灰反应,可用于除杂,故B正确;
C.二者都与Na2SO3溶液反应,应用NaHSO3除杂,故C错误;
D.H2S与CuSO4反应生成CuS沉淀,可除去杂质,故D正确.
故选C.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
17.下列说法正确的是( )
| A. | pH=5的H2S溶液中,c(H+)=c(HS一)=1×10-5mol•L-1 | |
| B. | 含有AgCl和AgI固体的悬浊液中,c(Ag+)>c(Cl-)=c(I-) | |
| C. | 在新制氯水中加入氯化钠固体,水的电离平衡不移动 | |
| D. |  若R为Zn,则如图采用了牺牲阳极的阴极保护法 |
14.下列叙述错误的是( )
| A. | 在NH4Cl饱和溶液中加入金属镁可以得到两种气体 | |
| B. | pH=12Ba(OH)2溶液中c(OH-)是0.001mol/LNaOH溶液c(OH-)的10倍 | |
| C. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) | |
| D. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的4倍,已知:KSP[Cd(OH)2]=7.2×10-15,Ksp[Co(OH)2]=1.8×10-15 |
1.稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素.回答下列问题;
(1)钪(Sc)元素的原子核外电子排布式为1s22s22p63s23p63d14s2.钬(Ho)的基态原子电子排布式为[Xe]4f116s2,一个基态钛原子所含的未成对电子数为2.
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数据判断表中最有可能有+4价的元素是Ce.
几种稀土元素的电离能(单位:kJ•mol-1)
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有共价键和配位键.
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(6)Ce(铈)单质为面心立方晶体,晶胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10}){\;}^{3}}$g•cm-3(不必计算出结果)
(1)钪(Sc)元素的原子核外电子排布式为1s22s22p63s23p63d14s2.钬(Ho)的基态原子电子排布式为[Xe]4f116s2,一个基态钛原子所含的未成对电子数为2.
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数据判断表中最有可能有+4价的元素是Ce.
几种稀土元素的电离能(单位:kJ•mol-1)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(6)Ce(铈)单质为面心立方晶体,晶胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10}){\;}^{3}}$g•cm-3(不必计算出结果)
11.有v1mL pH=9的氨水(A)和v2mL pH=10的氨水(B),v3mL pH=10的NaOH溶液(C),它们能中和同量的盐酸.以下叙述正确的是( )
| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2=v3 | |
| D. | 中和热A=B=C |
18.含不溶杂质的NaN03样品,加入一定量蒸馏水使其充分溶解,情况如表:
NaNO3溶解度(g/100g水)如表:
(1)实验中加入的水为300g;
(2)原样品中NaN03为372g.
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 201 | 132 | 72 |
| 温度(℃) | 10 | 40 | 75 |
| 溶解度 | 81 | 104 | 150 |
(2)原样品中NaN03为372g.
16.请根据短周期元素在元素周期表中的位置,结合所提供的图表回答下列问题:
(1)元素周期表第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,其中A的晶体类型是离子晶体,
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).
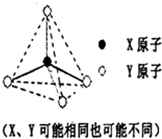
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
(2)推断符合下图立体结构的物质或微粒,其中属于原子晶体单质的有金刚石、晶体硅(填名称,下同);属于原子晶体氧化物的是二氧化硅;属于分子晶体的氢化物中沸点最低的是甲烷;属于阳离子,且该阳离子的硝酸盐溶液显酸性的理由是NH4++H2O?NH3.H2O+H+(用离子方程式表示).

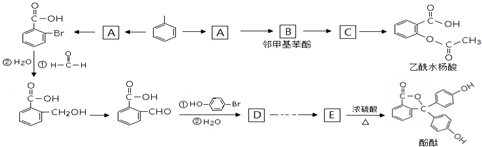
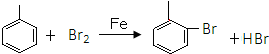 .
. ,E分子中的含氧官能团名称为羧基、羟基;
,E分子中的含氧官能团名称为羧基、羟基;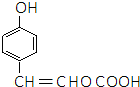 或
或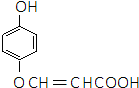 的邻、间、对的任意一种.
的邻、间、对的任意一种.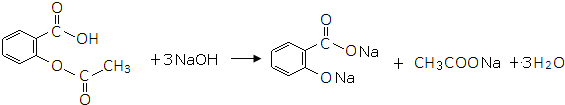 .
.