题目内容
【题目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。
(1)NH3 是一种很好的配体,氨气分子是_____(填“极性”或“非极性”)分子,NH3 的沸 点_____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:
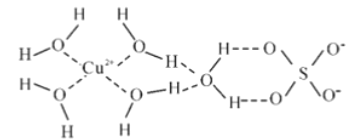
图中虚线表示的作用力为_________________________。
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是_____________,其中心原子的杂化轨道类型是________________ 。
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于_____________________ (填编号)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
【答案】 极性 高于 氢键、配位键 NH3、H2O、SO42- sp3 bc
【解析】(1)NH3的结构不对称,则氨气为极性分子,且分子间含氢键,则NH3的沸点高于AsH3,故答案为:极性;高于;
(2)通过图像知,图中虚线表示的作用力有铜离子和水分子之间的配位键,氢原子和另一分子中氧原子之间的氢键,故答案为:氢键、配位键;
(3)由SO42-离子中含有4个δ键,孤电子对数= ![]() =0,所以SO42-为正四面体结构,杂化轨道数=中心原子的孤电子对数+中心原子的δ键个数,所以S原子采用sp3杂化,NH3中含有3个δ键,孤电子对数=
=0,所以SO42-为正四面体结构,杂化轨道数=中心原子的孤电子对数+中心原子的δ键个数,所以S原子采用sp3杂化,NH3中含有3个δ键,孤电子对数=![]() =1,所以NH3的VSEPR 模型为正四面体结构,杂化轨道数=中心原子的孤电子对数+中心原子的δ键个数,所以N原子采用sp3杂化; H2O中含有2个δ键,孤电子对数=
=1,所以NH3的VSEPR 模型为正四面体结构,杂化轨道数=中心原子的孤电子对数+中心原子的δ键个数,所以N原子采用sp3杂化; H2O中含有2个δ键,孤电子对数=![]() =2,所以H2O的VSEPR 模型为正四面体结构,杂化轨道数=中心原子的孤电子对数+中心原子的δ键个数,所以O原子采用sp3杂化,故答案为:NH3、H2O、SO42;sp3;
=2,所以H2O的VSEPR 模型为正四面体结构,杂化轨道数=中心原子的孤电子对数+中心原子的δ键个数,所以O原子采用sp3杂化,故答案为:NH3、H2O、SO42;sp3;
(4)Ni(CO)4是液态挥发性物质,所以其熔点较低,故为分子晶体;呈正四面体构型,是对称结构,所以是非极性物质,根据相似相溶原理知,Ni(CO)4 易溶于非极性溶剂,苯、四氯化碳是非极性物质,所以Ni(CO)4 易溶于苯、四氯化碳,故答案为:bc。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案