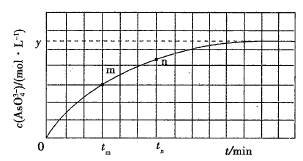
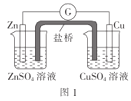
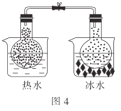
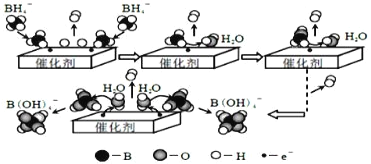
题目内容
【题目】下列说法中正确的是( )
A.铅蓄电池放电时,负极质量减轻,正极增重
B.升高CH3COONa溶液的温度,其水的离子积常数和pH均增大
C.CH3CH=CHCH3分子中的四个碳原子都在一条直线上
D.常温下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,则S(AgBr)>S(AgCl)
【答案】B
【解析】
A.铅蓄电池的负极反应为Pb-2e-+SO42-=PbSO4,负极由Pb转化为PbSO4,质量增加;正极反应为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,由PbO2转化为PbSO4,质量增加,A错误;
B.CH3COONa溶液中存在CH3COO-水解,CH3COO-+H2O![]() CH3COOH+OH-,也有水的电离,H2O
CH3COOH+OH-,也有水的电离,H2O![]() H++OH-。升高温度,水的电离被促进,水的离子积常数增大;CH3COO-的水解被促进,c(OH-)增大,pH增大,B正确;
H++OH-。升高温度,水的电离被促进,水的离子积常数增大;CH3COO-的水解被促进,c(OH-)增大,pH增大,B正确;
C.碳碳双键的碳原子与和其连接的原子形成的键角约为120°,因此CH3CH=CHCH3中的4个C原子没有在一条直线上,C错误;
D.对于同一类型的难溶物,可以根据它们Ksp的大小,比较它们溶解度的大小。Ksp(AgBr)<Ksp(AgCl),则S(AgBr)<S(AgCl),D错误。
答案选B。

【题目】某温度下,分别在下列容积为2L的恒容绝热密闭容器中,发生如下反应: 2CO(g)+SO2(g)=S(g)+2CO2(g) △H>0。测得相关数据如下表所示。
容器 | 起始时物质的量 | 平衡时CO(g)的浓度/mol·L | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 1 | a |
乙 | 1 | 0.5 | 0 | 0 | 0.2 |
丙 | 0 | 0 | 1 | 2 | b |
下列说法正确的是
A.平衡常数:K甲>K乙
B.a=0.4
C.若乙容器l0min达到平衡.则用S(g)表示的反应速率为0.005molL-1min-1
D.若将丙容器改为恒压绝热容器,则达到平衡时b=0.2