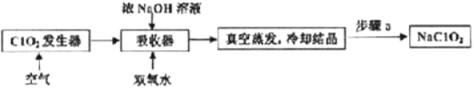
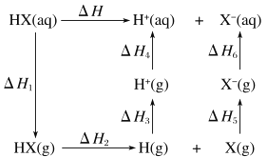
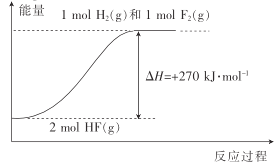
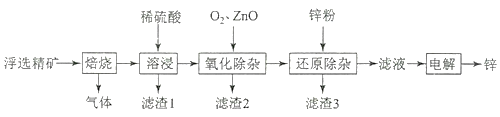
题目内容
【题目】根据原电池的知识,下列反应可设计成原电池的是( )
A.CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
B.Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
C.H2SO4+2NaOH=Na2SO4+2H2O
D.CaO+H2O=Ca(OH)2
【答案】A
【解析】
放热的氧化还原反应能够设计成原电池。
A.乙醇燃烧,是氧化还原反应,且反应放热,放出的热量能够转化为电能,可以设计成原电池,A符合题意;
B.该反应是吸热反应,而且也不是氧化还原反应,不能设计成原电池,B错误;
C.酸碱中和反应放热,但是反应中没有电子的转移,不能形成电流,不能设计成原电池,C错误;
D.CaO和水的反应是放热反应,但是该反应没有电子的转移,不能形成电流,不能设计成原电池,D错误。
答案选A。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是
选项 | 分子 | 空间构型 | 杂化方式 | 孤电子对数 |
A | NH3 | 平面三角形 | sp3杂化 | N含有一对孤电子对 |
B | CCl4 | 正四面体 | sp3杂化 | C不含有孤电子对 |
C | H2O | V形 | sp2杂化 | O含有两对孤电子对 |
D | CO32- | 三角锥形 | sp3杂化 | C含有一对孤电子对 |
A. AB. BC. CD. D
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。