题目内容
3.已知浓硫酸与木炭粉在加热条件下的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑十CO2↑2H2O↑.酸性KMnO4溶液可以吸收SO2,试用如图所示各装置设计一个实验,验证上述反应所产生的各种产物.| 编号 | ① | ② | ③ | ④ |
| 装置 | 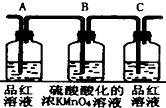 | 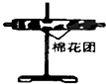 |  | 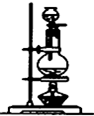 |
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是验证产物的SO2,B瓶溶液的作用是将SO2全部氧化吸收,C瓶溶液的作用是确定产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水硫酸铜,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间.
(4)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2.
分析 碳和浓硫酸在加热条件下反应生成SO2、CO2和水,检验二氧化碳和二氧化硫时用到的溶液中均含有水,首先用无水硫酸铜检验产物水,SO2和CO2均能使澄清石灰水变浑浊,故应先用B中品红溶液检验二氧化硫,后用澄清石灰水检验二氧化碳,在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,C中品红溶液用于检验SO2是否除干净.
解答 解:碳和浓硫酸在加热条件下反应生成SO2、CO2和水,检验二氧化碳和二氧化硫时用到的溶液中均含有水,首先用无水硫酸铜检验产物水,SO2和CO2均能使澄清石灰水变浑浊,故应先用B中品红溶液检验二氧化硫,后用澄清石灰水检验二氧化碳,在用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾溶液用于吸收SO2,C中品红溶液用于检验SO2是否除干净.
(1)由上述分析可知,装置的连接顺序(按产物气流从左到右的方向)是:④→②→①→③,
故答案为:④→②→①→③;
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是:检验产物中的SO2,B瓶溶液的作用是:将SO2全部氧化吸收,C瓶溶液的作用是:确定产物中SO2已被B瓶溶液全部氧化,
故答案为:验证产物中是否有SO2;将SO2全部氧化吸收;确定产物中SO2已被B瓶溶液全部氧化;
(3)装置②是检验水的生成,可以通过无水硫酸铜是否变蓝来检验水的产生,由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间;
故答案为:无水硫酸铜;水蒸气;产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间;
(4)装置③检验二氧化碳,CO2能使澄清石灰水变浑浊,用澄清石灰水检验二氧化碳的存在,
故答案为:澄清石灰水;CO2.
点评 本题考查了浓硫酸性质实验、物质检验、实验方案设计与评价,侧重于物质的检验原理的考查,注意理解物质检验顺序,是对学生综合能力的考查,难度中等,

 优学名师名题系列答案
优学名师名题系列答案| A. | HNO3溶液 | B. | NaOH溶液 | C. | H2SO4溶液 | D. | 盐酸 |
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NaHSO4溶液中加入Ba(OH)2溶液至SO42完全沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | (NH4)2Fe(SO4)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
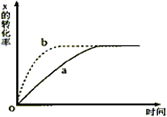 如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )
如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )| A. | 升高温度 | B. | X的投入量增加 | C. | 加催化剂 | D. | 减小容器体积 |
| A | B | C | D | |
| 阳极 | 蓝 | 白 | 红 | 蓝 |
| 阴极 | 白 | 蓝 | 蓝 | 蓝 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4溶液、石蕊试液褪色 | |
| B. | 能使品红褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性 |