题目内容
12.(1)冶金工业上为了降低硫的氧化物对空气的污染,常用CO在500℃,铝矾土催化下还原SO2除去烟道废气回收硫,写出该反应的化学方程式为2CO+SO2$\frac{\underline{\;催化剂\;}}{500℃}$2CO2+S.(2)已知:①SO2能破坏大气层外的臭氧层;②氧气在放电条件下产生臭氧.
现用排空气法收集一瓶SO2,并用电子枪对其扫描放电,写出反应的化学方程式:3O2$\frac{\underline{\;放电\;}}{\;}$2O3、O3+SO2=SO3+O2.
分析 (1)CO在500℃,铝矾土催化下还原SO2除去烟道废气回收硫,可知发生氧化还原反应,生成S和二氧化碳;
(2)氧气在放电条件下产生臭氧,臭氧与二氧化硫发生氧化还原反应生成氧气和三氧化硫.
解答 解:(1)CO在500℃,铝矾土催化下还原SO2除去烟道废气回收硫,反应的方程式为2CO+SO2$\frac{\underline{\;催化剂\;}}{500℃}$2CO2+S,故答案为:为2CO+SO2$\frac{\underline{\;催化剂\;}}{500℃}$2CO2+S;
(2)氧气在放电条件下产生臭氧,方程式为3O2$\frac{\underline{\;放电\;}}{\;}$2O3,臭氧与二氧化硫发生氧化还原反应生成氧气和三氧化硫,方程式为O3+SO2=SO3+O2,
故答案为:3O2$\frac{\underline{\;放电\;}}{\;}$2O3;O3+SO2=SO3+O2.
点评 本题考查二氧化硫的性质,为高频考点,综合考查元素化合物知识,注意把握题给信息,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
18.在下列影响化学反应速率因素中,肯定能使化学反应速率加快的方法是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末.
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末.
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有③④ | D. | ①②③④ |
3.已知浓硫酸与木炭粉在加热条件下的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑十CO2↑2H2O↑.酸性KMnO4溶液可以吸收SO2,试用如图所示各装置设计一个实验,验证上述反应所产生的各种产物.
(1)这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):④→②→①→③.
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是验证产物的SO2,B瓶溶液的作用是将SO2全部氧化吸收,C瓶溶液的作用是确定产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水硫酸铜,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间.
(4)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2.
| 编号 | ① | ② | ③ | ④ |
| 装置 | 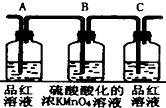 | 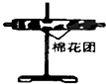 |  | 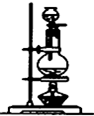 |
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是验证产物的SO2,B瓶溶液的作用是将SO2全部氧化吸收,C瓶溶液的作用是确定产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水硫酸铜,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是产物气流通过①、③时会带出水蒸气,所以②必须在①、③之间.
(4)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2.
20.下列物质的分类采用树状分类法的是( )
| A. | 铁是单质,又是导体 | |
| B. | 氧化物可分为金属氧化物和非金属氧化物 | |
| C. | 氯化钠是钠的化合物,又是氯化物 | |
| D. | 氢氧化钙是纯净物、化合物,又是碱 |
17.除去铝表面的铜镀层可选用的试剂是( )
| A. | 浓硝酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 浓硫酸 |
4.在标准状况下,有一氧化碳和二氧化碳的混合气体5.6L.如果一氧化碳的质量为5.6g,则二氧化碳的质量为( )
| A. | 4.4g | B. | 3.3g | C. | 1.1g | D. | 2.2g |
2.在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-Q1kJ/mol; 2H2(g)+O2(g)=2H2O(g))△H=-Q2kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)△H=-Q1kJ/mol; S(s)+O2(g)=SO2(g))△H=-Q2kJ/mol | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO2(g))△H=-Q1kJ/mol; C(s)+O2(g)=CO(g))△H=-Q2kJ/mol | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H=-Q1kJ/mol; $\frac{1}{2}$H2(g)+Cl2(g)=HCl(g))△H=-Q2kJ/mol |