题目内容
19.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 1molCH3+(碳正离子)中含有电子数为10NA | |
| B. | 1mol铜与足量硫蒸气反应,转移电子数为2NA | |
| C. | 用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA | |
| D. | 0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA |
分析 A.碳正离子中含有8个电子,1molCH3+(碳正离子)中含有8mol电子;
B.铜与硫反应生成硫化亚铜,1mol铜与足量硫蒸气反应失去1mol电子;
C.依据电解反应和电子守恒计算分析;
D.根据碳酸氢钠晶体中含有的离子为钠离子和碳酸氢根离子判断.
解答 解:A.1molCH3+(碳正离子)中含有8mol电子,含有电子数为8NA,故A错误;
B.1mol铜与足量硫蒸气反应生成0.5mol硫化亚铜,转移了1mol电子,转移电子数为NA,故B错误;
C.依据电极反应和电子守恒计算分析,用惰性电极电解CuCl2溶液,阴极析出32g铜时物质的量为0.5mol,Cu2++2e-=Cu,线路中通过的电子数为NA,故C正确;
D.0.84gNaHCO3晶体的物质的量为0.01mol,含有0.01mol钠离子和0.01mol碳酸氢根离子,含有的阳离子和阴离子总数为0.02NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数,题目难度不大,注意碳酸氢钠固体中的离子为钠离子和碳酸氢根离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.如图装置或操作能达到实验目的是( )
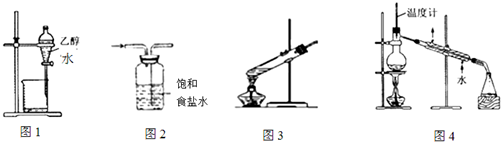

| A. | 图1装置用于分离乙醇和水 | B. | 图2装置用于除去氯气中的氯化氢 | ||
| C. | 图3装置用于葡萄糖的银镜反应 | D. | 图4装置用于石油的蒸馏 |
7.下列溶液中的各组离子,一定能够大量共存的是( )
| A. | pH=3的无色溶液:Na+、Cl-、Fe2+、ClO- | |
| B. | 使石蕊溶液变红的溶液:Na+、Cl-、SO42-、AlO2- | |
| C. | 与Al产生H2的溶液:K+、SO42-、CO32-、NH4+ | |
| D. | 水电离的c(H+)=1×10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- |
14.下列排序不正确的是( )
| A. | 晶体熔点的高低: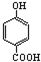 > >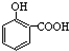 | |
| B. | 原子的价层电子数目的多少:Fe>As>K | |
| C. | 分子中的键角大小:CO2>H2O>NH3 | |
| D. | 微粒半径的大小:O2->F->Na+>Li+ |
4.NH4H与NH4 Cl的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水,所形成的溶液显酸性 | |
| C. | NH4H与水反应时,NH4H是还原剂 | |
| D. | NH4H固体投入少量的水中,有两种气体生成 |
11.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为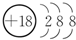 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
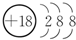 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
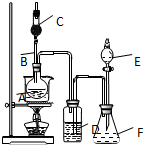 为证明乙醇分子中含有氧原子,运用R-OH+HCl═RCl+H2O反应生成的水(H2O),检测其中的氧.现采用一套如图所示装置进行实验. 装置中所装的试剂:
为证明乙醇分子中含有氧原子,运用R-OH+HCl═RCl+H2O反应生成的水(H2O),检测其中的氧.现采用一套如图所示装置进行实验. 装置中所装的试剂: X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知: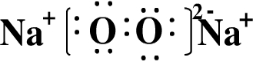 ,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.