题目内容
11. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z+与Y2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为
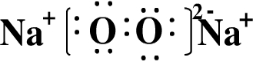 ,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.(2)X、Y、Z三种元素所形成的常见化合物的名称为碳酸钠;XY2的结构式为O=C=O,分子的立体构型为直线型.
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是金刚石(填名称);晶体ZW的熔点比晶体XW4明显高的原因是NaCl为离子晶体而CCl4为分子晶体.
(4)ZW晶体的结构示意图如图.已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d=$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{ρ{N}_{A}}}$.
分析 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,由
①X元素原子价电子排布式为ns2np2,为第ⅣA元素,且原子半径是同族元素中最小的,则为C;
②Y元素是地壳中含量最多的元素,则Y为O;W在同周期中原子半径最小,在W原子的电子排布中,p轨道上只有1个未成对电子,则W为Cl,
③Z元素的电离能数据可知,Z最外层有1个电子,原子序数比O的大,则为Na,然后结合元素及化合物知识及化学用语来解答.
解答 解:X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,由
①X元素原子价电子排布式为ns2np2,为第ⅣA元素,且原子半径是同族元素中最小的,则为C;
②Y元素是地壳中含量最多的元素,则Y为O;W在同周期中原子半径最小,在W原子的电子排布中,p轨道上只有1个未成对电子,则W为Cl,
③Z元素的电离能数据可知,Z最外层有1个电子,原子序数比O的大,则为Na,
(1)Z2Y2的电子式为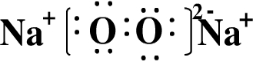 ,Na2O2含有的化学键类型为离子键和共价键,Na2O2为离子晶体,
,Na2O2含有的化学键类型为离子键和共价键,Na2O2为离子晶体,
故答案为: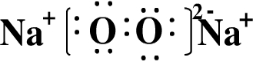 ;离子键和共价键;离子;
;离子键和共价键;离子;
(2)X为C、Y为O、Z为Na,三种元素所形成的常见化合物为Na2CO3,其名称为碳酸钠,XY2为CO2,结构式为O=C=O,分子的立体构型为直线型,
故答案为:碳酸钠;O=C=O;直线型;
(3)X、Y、Z、W四种元素所形成的单质分别为金刚石、氧气、钠、氯气,其中金刚石为原子晶体,其熔点最高、硬度最大,晶体NaCl为离子晶体而CCl4是分子晶体,所以NaCl的熔点比CCl4明显高,
故答案为:金刚石;NaCl为离子晶体而CCl4为分子晶体;
(4)根据NaCl晶体的结构示意图可知,每个晶胞中含有钠离子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,氯离子数为$12×\frac{1}{4}$+1=4,根据ρ=$\frac{m}{V}$可知,V=$\frac{\frac{4M}{{N}_{A}}}{ρ}$=$\frac{4M}{ρ{N}_{A}}$,所以晶胞的边长为$\root{3}{\frac{4M}{ρ{N}_{A}}}$,晶胞的面对角线为$\sqrt{2}\root{3}{\frac{4M}{ρ{N}_{A}}}$,根据晶胞结构可知,NaCl晶体中两个最近的钠离子中心间的距离d应为晶胞面对角线的一半,所以d=$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{ρ{N}_{A}}}$,
故答案为:$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{ρ{N}_{A}}}$.
点评 本题考查物质结构及其性质,推断元素是解答本题关键,注意利用价层电子对互斥理论分析分子空间构型,综合性较强,题目难度不大.

湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移3 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
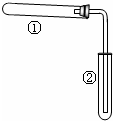 如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 |
| 铁粉与水蒸气加热 | 肥皂水冒泡 |
| 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| NaHCO3 | 澄清石灰水变浑浊 |
| 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
| A. | 1molCH3+(碳正离子)中含有电子数为10NA | |
| B. | 1mol铜与足量硫蒸气反应,转移电子数为2NA | |
| C. | 用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA | |
| D. | 0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA |
(1)适当提高氨的合成速率(2)提高氢气的转化率(3)提高氨的产率(4)催化剂在5000C时活性最大.
| A. | 只有(1) | B. | (1)(2) | C. | (2)(3)(4) | D. | (1)(4) |
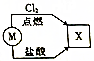 如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )
如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )| A. | SiCl4 | B. | FeCl2 | C. | KCl | D. | AlCl3 |
| A. | 传统无机非金属材料是指:光导纤维、玻璃、水泥、陶瓷等硅酸盐材料 | |
| B. | 新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差 | |
| C. | 高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点 | |
| D. | 传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 |