题目内容
14.下列排序不正确的是( )| A. | 晶体熔点的高低: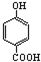 > >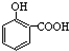 | |
| B. | 原子的价层电子数目的多少:Fe>As>K | |
| C. | 分子中的键角大小:CO2>H2O>NH3 | |
| D. | 微粒半径的大小:O2->F->Na+>Li+ |
分析 A.根据分子间氢键增大熔点,分子内氢键降低熔点判断;
B.根据价层电子排布式判断;
C.根据分子的空间构型判断;
D.电子层数越大,半径越大;核外电子排布相同的离子,核电核数越大,半径越小.
解答 解:A.因为对位形成分子间氢键增大熔点,邻位形成分子内氢键降低熔点,所以晶体熔点的高低: >
> ,故A正确;
,故A正确;
B.Fe价层电子排布式为3d64s2,As价层电子排布式为4s24p3,K价层电子排布式为4s1,所以价层电子数目的多少:Fe>As>K,故B正确;
C.二氧化碳为直线形结构,键角为180°,水为V型分子,键角为105°,氨气为三角锥型,键角为107°,所以键角大小:CO2>NH3>H2O,故C错误;
D.核外电子排布相同的离子,核电核数越大,半径越小,所以半径O2->F->Na+,电子层数越大,半径越大,所以半径:O2->F->Na+>Li+,故D正确;
故选:C.
点评 本题考查晶体的物理性质,题目难度中等,注意把握比较角度,学习中注意方法的积累.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
5.m g 铜与足量浓硫酸完全反应,放出的气体经干燥后为n L,则被还原的硫酸为( )
| A. | $\frac{m}{64}$ g | B. | $\frac{48m}{32}$$\frac{49m}{32}$g | C. | $\frac{n}{22.4}$mol | D. | 不能确定 |
2.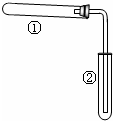 如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
 如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 |
| 铁粉与水蒸气加热 | 肥皂水冒泡 |
| 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| NaHCO3 | 澄清石灰水变浑浊 |
| 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
9.用2mL 1mol•L-1CuSO4溶液与3mL 0.5mol•L-1 NaOH溶液混合后,加入40%的甲醛溶液0.5mL,加热至沸腾,无红色沉淀生成,实验失败的主要原因是( )
| A. | 甲醛的量太少 | B. | CuSO4的量太多 | C. | NaOH的量太少 | D. | 加热的时间太短 |
19.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1molCH3+(碳正离子)中含有电子数为10NA | |
| B. | 1mol铜与足量硫蒸气反应,转移电子数为2NA | |
| C. | 用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA | |
| D. | 0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA |
6.工业上合成氨时一般采用500℃左右的温度,其原因是( )
(1)适当提高氨的合成速率(2)提高氢气的转化率(3)提高氨的产率(4)催化剂在5000C时活性最大.
(1)适当提高氨的合成速率(2)提高氢气的转化率(3)提高氨的产率(4)催化剂在5000C时活性最大.
| A. | 只有(1) | B. | (1)(2) | C. | (2)(3)(4) | D. | (1)(4) |
3.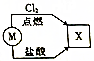 如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )
如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )
 如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )
如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )| A. | SiCl4 | B. | FeCl2 | C. | KCl | D. | AlCl3 |
6.I、根据如图所示各物质间的转化关系,回答(1)-(3)三个小题:

(1)写出D物质中官能团的结构式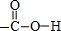
(2)①~⑥反应中属于取代反应的是②
(3)写出②和⑦反应的化学方程式
②CH2BrCH2Br+2NaOH$\stackrel{△}{→}$HOCH2CH2OH+2NaBr⑦CaC2+2H2O=Ca(OH)2+C2H2↑
II、根据下面的反应路线及所给信息回答(4)-(7)四个小题
X$→_{①}^{Cl_{2},光照}$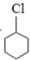 $\stackrel{②}{→}$
$\stackrel{②}{→}$ $\stackrel{③}{→}$Y$\stackrel{④}{→}$
$\stackrel{③}{→}$Y$\stackrel{④}{→}$
(4)请按要求填写下列表格中未画虚线的所有空白
(5)反应④的化学方程式是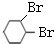 +2NaOH $→_{△}^{醇}$
+2NaOH $→_{△}^{醇}$ 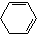 +2NaBr+2H2O
+2NaBr+2H2O
已知: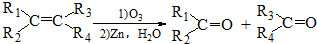 (R1、R2、R3、R4为烃基或H)
(R1、R2、R3、R4为烃基或H)
(6)根据以上信息完成M被氧化的化学方程式(不要求配平但有机产物要写全):
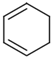 $→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,
$→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,
(7)写出符合下列条件的所有有机物的结构简式CH3CH2C≡CCH=CH2、CH3C≡CCH2CH=CH2.
①与M互为同分异构体 ②属于脂肪烃 ③分子结构中无支链 ④核磁共振氢谱显示有四个峰且峰面积之比为1:2:2:3.

(1)写出D物质中官能团的结构式
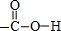
(2)①~⑥反应中属于取代反应的是②
(3)写出②和⑦反应的化学方程式
②CH2BrCH2Br+2NaOH$\stackrel{△}{→}$HOCH2CH2OH+2NaBr⑦CaC2+2H2O=Ca(OH)2+C2H2↑
II、根据下面的反应路线及所给信息回答(4)-(7)四个小题
X$→_{①}^{Cl_{2},光照}$
 $\stackrel{②}{→}$
$\stackrel{②}{→}$ $\stackrel{③}{→}$Y$\stackrel{④}{→}$
$\stackrel{③}{→}$Y$\stackrel{④}{→}$
(4)请按要求填写下列表格中未画虚线的所有空白
| 反应① | 反应② | 反应③ | |
| 试剂及条件 | |||
| 反应类型 |
 +2NaOH $→_{△}^{醇}$
+2NaOH $→_{△}^{醇}$  +2NaBr+2H2O
+2NaBr+2H2O已知:
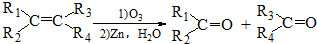 (R1、R2、R3、R4为烃基或H)
(R1、R2、R3、R4为烃基或H)(6)根据以上信息完成M被氧化的化学方程式(不要求配平但有机产物要写全):
 $→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,
$→_{(2)Zn,H_{2}O}^{(1)O_{3}}$OHC-CH2CH2CHO+OHC-CHO,产物中含氧官能团的名称是醛基,(7)写出符合下列条件的所有有机物的结构简式CH3CH2C≡CCH=CH2、CH3C≡CCH2CH=CH2.
①与M互为同分异构体 ②属于脂肪烃 ③分子结构中无支链 ④核磁共振氢谱显示有四个峰且峰面积之比为1:2:2:3.