题目内容
8.在反应2KMnO4+16HCl(浓)═2MnCl2 +2KCl+5Cl2 ↑+8H2O中.(1)氧化剂是KMnO4,氧化产物是Cl2(填化学式);
(2)若生成71g Cl2 ,则被氧化的HCl是2mol,转移的电子的物质的量是2mol.
分析 2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:(1)2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O中,Mn元素的化合价降低,则KMnO4为氧化剂,Cl元素的化合价升高,失去电子被氧化,则Cl2为氧化产物,故答案为:KMnO4;Cl2;
(2)若生成71gCl2,其物质的量为$\frac{71g}{71g/mol}$=1mol,由Cl原子守恒可知被氧化的HCl是2mol,转移电子为2mol×[0-(-1)]=2mol,
故答案为:2;2.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子计算的考查,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
18.下列推断正确的是( )
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| C. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| D. | SO2和新制氯水均有漂白性,将SO2和Cl2通入滴加少量紫色石蕊试液,充分振荡后溶液最终呈无色 |
19.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1molCH3+(碳正离子)中含有电子数为10NA | |
| B. | 1mol铜与足量硫蒸气反应,转移电子数为2NA | |
| C. | 用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA | |
| D. | 0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA |
3.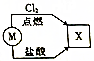 如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )
如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )
 如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )
如图所示的转化关系中,若M为短周期元素形成的金属单质,则X可能是( )| A. | SiCl4 | B. | FeCl2 | C. | KCl | D. | AlCl3 |
13.下表是四个反应的有关信息:
下列结论正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A. | 第①组反应的氧化产物一定只有FeCl3(实为Fe3+) | |
| B. | 第③组反应的产物还有KCl和H2O | |
| C. | 氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ | |
| D. | 还原性比较:H2O2>Mn2+>Cl- |
2.下列关于无机非金属材料的说法中正确的是( )
| A. | 传统无机非金属材料是指:光导纤维、玻璃、水泥、陶瓷等硅酸盐材料 | |
| B. | 新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差 | |
| C. | 高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点 | |
| D. | 传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 |
20.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBr的稳定性比HI强 |
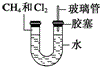 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.