题目内容
7.下列溶液中的各组离子,一定能够大量共存的是( )| A. | pH=3的无色溶液:Na+、Cl-、Fe2+、ClO- | |
| B. | 使石蕊溶液变红的溶液:Na+、Cl-、SO42-、AlO2- | |
| C. | 与Al产生H2的溶液:K+、SO42-、CO32-、NH4+ | |
| D. | 水电离的c(H+)=1×10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- |
分析 A.pH=3的溶液中存在大量氢离子,次氯酸根离子能够与氢离子反应,次氯酸根离子能够氧化亚铁离子,且亚铁离子为有色离子;
B.使石蕊溶液变红的溶液为酸性溶液,偏铝酸根离子与氢离子反应;
C.与Al产生H2的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应,碳酸根离子与氢离子反应;
D.该溶液为酸性或碱性溶液,四种离子之间不反应,都不与氢离子、氢氧根离子反应.
解答 解:A.pH=3的无色溶液中存在大量氢离子,Fe2+、ClO-之间发生氧化还原反应,ClO-与氢离子反应,且Fe2+为有色离子,在溶液中不能大量共存,故A错误;
B.该溶液为酸性溶液,溶液中存在大量氢离子,AlO2-与氢离子反应,在溶液中不能大量共存,故B错误;
C.与Al产生H2的溶液为酸性或强碱性溶液,NH4+与强碱性溶液反应,CO32-与酸性溶液反应,在溶液中一定不能大量共存,故C错误;
D.水电离的c(H+)=1×10-12 mol•L-1的溶液为酸性或碱性溶液,K+、Ba2+、Cl-、Br-之间不反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还需要注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”.

练习册系列答案
相关题目
17.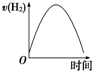 镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
 镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )| A. | 镁条的质量 | B. | 镁条的表面积 | C. | Cl-的浓度 | D. | 压强 |
18.下列推断正确的是( )
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| C. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| D. | SO2和新制氯水均有漂白性,将SO2和Cl2通入滴加少量紫色石蕊试液,充分振荡后溶液最终呈无色 |
15.为扩大现有资源的使用效率,在一些油品中加入了降凝制剂J,以降低油料的凝固点,扩大燃料油的使用范围.J是一种高分子化合物: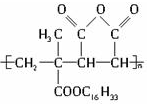 下列有关J的说法正确的是( )
下列有关J的说法正确的是( )
 下列有关J的说法正确的是( )
下列有关J的说法正确的是( )| A. | J是由2种单体缩聚而成的 | B. | J是由2种单体加聚而成的 | ||
| C. | J具有可燃性 | D. | J没有可燃性 |
2.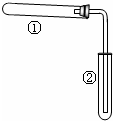 如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
 如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 |
| 铁粉与水蒸气加热 | 肥皂水冒泡 |
| 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| NaHCO3 | 澄清石灰水变浑浊 |
| 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
12.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | PCl3 | B. | H2S | C. | BeCl2 | D. | SF6 |
19.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1molCH3+(碳正离子)中含有电子数为10NA | |
| B. | 1mol铜与足量硫蒸气反应,转移电子数为2NA | |
| C. | 用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA | |
| D. | 0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA |
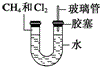 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.