题目内容
12.在一定体积的18mol•L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的体积为( )| A. | 等于50 mL | B. | 大于50 mL | C. | 等于100 mL | D. | 大于100 mL |
分析 Cu与浓硫酸发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,反应中硫酸起氧化剂、酸性作用,各占一半,根据被还原的硫酸计算参加反应硫酸的物质的量,进而计算实际参加反应硫酸溶液的体积,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,实际硫酸溶液体积偏大.
解答 解:Cu与浓硫酸发生反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,反应中硫酸起氧化剂、酸性作用,各占一半,故参加反应硫酸为0.9mol×2=1.8mol,其体积为$\frac{1.8mol}{18mol/L}$=0.1L=100mL,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,实际硫酸溶液体积应大于100mL,故选D.
点评 本题考查化学方程式有关计算,难度不大,关键明确“随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应”.

练习册系列答案
相关题目
3.将一小段镁带投入盛有稀盐酸的试管中,发生剧烈反应.一段时间后,用手触摸试管外壁感觉烫手.这个实验事实说明该反应( )
| A. | 为放热反应 | |
| B. | 为吸热反应 | |
| C. | 反应过程中热能转化为化学能 | |
| D. | 反应物的总能量低于生成物的总能量 |
20.下列各组混合物中,可以用分液漏斗分离的是( )
| A. | 溴乙烷和水 | B. | 苯酚和乙醇 | C. | 酒精和水 | D. | 乙醛和苯 |
7.除去CH4中混有的少量C2H4,可将混合气体通入以下哪种溶液( )
| A. | 溴水 | B. | 蒸馏水 | C. | 苯 | D. | CCl4 |
17.下列性质适合于离子晶体的是( )
| A. | 熔点-218℃,难溶于水 | |
| B. | 熔点3 900℃,硬度很大,不导电 | |
| C. | 难溶于水,固体时导电,升温时导电能力减弱 | |
| D. | 难溶于水,熔点高,固体不导电,熔化时导电 |
4.一定质量的某有机物与足量金属钠反应要得VAL气体.相同质量的该有机物与足量的NaHCO3浓溶液反应,可得VBL气体.已知在同温同压下VA和VB相同,则该有机物可能是( )
| A. | CH3CH(OH)COOH | B. | HOOC-COOH | ||
| C. | CH3CH2CH2OH | D. |  |
1.下列有关物质用途的说法中,不正确的是( )
| A. | 四氯化碳可做有机溶剂 | |
| B. | 可用工业酒精勾兑白酒 | |
| C. | 甲烷是清洁高效的燃料 | |
| D. | 用二氯甲烷只有一种结构证明甲烷空间结构是正四面体 |
2.CoCl2•6H2O是一种饲料营养强化剂.以含钴单质废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
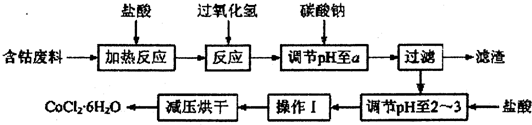
已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,假设杂质不与AgNO3溶液反应,结果保留两位有效数字)

已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,假设杂质不与AgNO3溶液反应,结果保留两位有效数字)