题目内容
19.锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分.其中生产碳酸锰的工艺流程如下: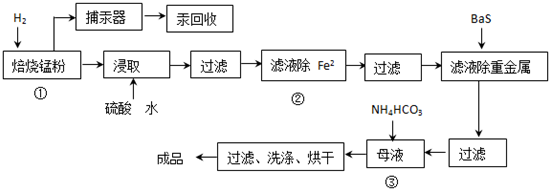
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物.
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部分被碳还原,MnO2被还原为一氧化锰.已知:
2MnO2(s)+c(s)=2MnO(s)+CO2(g);△H=-174.6kJ•mol-1
C(s)+CO2(g)=2CO(g);△H=283kJ•mol-1
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:MnO2(s)+C(s)=MnO(s)+CO(g)△H=+54.2kJ•mol-1.
(3)50-55℃时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4
2NH4HCO3=(NH4)2SO4+□MnCO3↓+□H2O+□CO2↑
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7-3.7,Mn2+:8.6-10.1,Fe2+:7.6-9.6
步骤②中除去的方法是先在酸性条件下加入H2O2,将Fe2+氧化为Fe3+,然后再将pH调至3.7~8.6使Fe3+沉淀完全.
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:Mn2++2H2O-2e-=MnO2+4H+.
分析 原料锰粉粗品的主要成分为MnO2和碳,焙烧时碳被MnO2氧化为一氧化碳,碳把二氧化锰还原为一氧化锰,应氢气还原一氧化锰得到锰单质,从流程看,还有铁单质;加入硫酸生成硫酸锰、硫酸亚铁和氢气,碳不反应,过滤除去不溶性物质如碳等,滤液中含亚铁离子、锰离子.由题给离子沉淀PH可知,除亚铁离子,需先用氧化剂氧化亚铁离子变成铁离子,再调节PH使铁离子沉淀,而锰离子不沉淀,过滤后滤液中含锰离子,加入碳酸氢铵得到碳酸锰沉淀,过滤洗涤干燥得成品碳酸锰,
(1)电池外壳锌皮与硫酸反应可以生成氢气;
(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;
(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,根据形成沉淀的pH范围分析;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子.
解答 解:(1)锌锰废电池的负极为锌,即电池外壳锌皮,锌与硫酸反应可以生成氢气,则流程中氢气的来源为:用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物,
故答案为:用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物;
(2)已知:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-174.6kJmol-1 ①,
C(s)+CO2(g)═2CO(g)△H=+283kJmol-1 ②
由盖斯定律:(①+②)×$\frac{1}{2}$得 MnO2(s)+C(s)=MnO(s)+CO(g)△H=(-174.6+283)×$\frac{1}{2}$=+54.2kJ•mol-1;
故答案为:MnO2(s)+C(s)=MnO(s)+CO(g)△H=+54.2kJ•mol-1;
(3)该流程的目的是制取碳酸锰,向MnSO4的母液中加入足量NH4HCO3,反应生成碳酸锰之外,还会生成二氧化碳和水,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
故答案为:MnCO3↓;H2O;CO2↑;
(4)将Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,可以用H2O2,其还原产物为水不会引入新的杂质;控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,已知离子沉淀时的pH范围:Fe3+:2.7-3.7,Mn2+:8.6-10.1,则调节pH为3.7~8.6之间,使Fe3+完全沉淀,而Mn2+不沉淀;
故答案为:H2O2;3.7~8.6;
(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子,其电极方程式为:Mn2++2H2O-2e-=MnO2+4H+;
故答案为:Mn2++2H2O-2e-=MnO2+4H+.
点评 本题考查了物质制备方案设计,题目涉及盖斯定律的应用、离子方程式的书写、电极反应式的书写、氧化剂的选择等知识,题目难度中等,侧重于考查学生对基础知识的综合应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 碳酸氢钠溶液和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 碳酸钾溶液与稀硫酸反应:CO32-+H+═CO2↑+H2O | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 实验室制取氧气:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2K++2Cl-+3O2↑ |
| A. | Mg(OH)2+2 HCL═Mg CL2+2 H2O | B. | 2 NaOH+H2SO4═Na2SO4+2 H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4+2 H2O | D. | 2 HCL+Cu(OH)2═CuCL2+2 H2O |
 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空: