题目内容
8.海水是一个巨大的化学资源库,如图是海水综合利用的部分工艺流程图:
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.
(1)在过程①中应加入下列沉淀剂的顺序是CAB、CBA或BCA(填序号),同时加入盐酸将滤液的pH调至酸性,除去的离子是CO32-、OH-(填离子符号).
A.Na2CO3 B.NaOH C.BaCl2
(2)过程②中反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(3)简述过程③中如何获得无水MgCl2:在干燥的HCl气流中加热MgCl2•6H2O晶体.
(4)写出过程④的化学方程式:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.简述工业上不使用电解MgO的方法制取金属镁的原因:MgO的熔点远高于MgCl2的熔点.
(5)将由母液获得的NaBr溶液浓缩、酸化,并通入Cl2,充分反应,再向其中吹入热空气,将生成的溴吹出,过程⑤用纯碱溶液吸收,过程⑤发生反应的离子方程式为3Br2+3CO32-═5Br-+BrO3-+3CO2↑.过程⑥是将过程⑤所得溶液用稀H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用萃取(填操作方法)的方法提取溴,还可以得到副产品Na2SO4,写出过程⑥的离子方程式:5Br-+BrO3-+6H+═3Br2+3H2O.
分析 海水晒盐后得到粗盐和母液,粗盐加入氢氧化钠、氯化钡、碳酸钠、盐酸精制除杂得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,母液中加入氢氧化钙浊液沉淀镁离子,过滤得到氢氧化镁沉淀,加入盐酸溶解后得到氯化镁溶液,蒸发浓缩,冷却结晶,过滤洗涤得到氯化镁晶体,在氯化氢气流中加热失水得到氯化镁固体,电解熔融氯化镁得到金属镁和氯气,滤液中加入氯气氧化溴离子得到溴单质的低浓度溶液,加入碳酸钠溶液吸收溴单质,再加入稀硫酸,发生归中反应得到高浓度的溴单质溶液;
(1)根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(2)电解饱和食盐水生成氢氧化纳、氢气和氯气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(3)氯化镁晶体加热失去结晶水,镁离子水解生成氢氧化镁,在氯化氢气流中加热失水得到氯化镁;
(4)过程④是电解熔融的氯化镁生成镁和氯气,若在空气中加热MgCl2•6H2O生成的是Mg(OH)Cl或MgO,而MgO的熔沸点非常高,达到熔融状态需要消耗很多能源.所以,用电解法制取金属镁时,需要无水氯化镁;
(5)过程⑤用纯碱溶液吸收溴单质,产生的Br2用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等,过程⑥是将过程⑤所得溶液用稀H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,Br-、BrO3-在酸性条件下发生反应生成Br2,用有机溶剂萃取溴,滤液中含有硫酸钠.
解答 解:(1)总体思路是先沉淀再过滤,沉淀时要先加BaCl2溶液,再加Na2CO3溶液,因为碳酸钠能把过量的氯化钡沉淀出来,氢氧化钠可放在它们前面,也可放在它们后面或中间,都完全沉淀完后再过滤,加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,
故答案为:CAB或者CBA或者BCA;CO32-和OH-;
(2)电解饱和食盐水制取氯气的反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)氯化镁晶体加热失去结晶水,镁离子水解生成氢氧化镁,在氯化氢气流中加热失水得到氯化镁,过程③中获得无水MgCl2,在干燥的HCl气流中加热MgCl2•6H2O晶体,
故答案为:在干燥的HCl气流中加热MgCl2•6H2O晶体;
(4)电解熔融的氯化镁得到Mg与氯气,反应方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,MgO的熔沸点非常高,达到熔融状态需要消耗很多能源.所以,用电解法制取金属镁时,需要无水氯化镁.
故答案为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;MgO的熔点远高于MgCl2的熔点;
(5)过程⑤用纯碱溶液吸收溴单质,产生的Br2用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等,反应的离子方程式为:3Br2+3CO32-═5Br-+BrO3-+3CO2↑,过程⑥是将过程⑤所得溶液用稀H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,Br-、BrO3-在酸性条件下发生反应生成Br2,Br-、BrO3-在酸性条件下发生反应生成Br2,根据元素守恒可知还生成H2O,反应离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,用有机溶剂萃取溴,过程中得到滤液中含有硫酸钠,
故答案为:3Br2+3CO32-═5Br-+BrO3-+3CO2↑;萃取;Na2SO4;5Br-+BrO3-+6H+═3Br2+3H2O.
点评 本题以海水资源及其利用为载体综合考查物质的分离、制备,侧重于学生的分析、实验能力的考查,题目涉及金属的冶炼、物质的分离和提纯、氧化还原反应等知识点,能从总体上分析工艺流程图,知道每一步发生的反应或操作方法,熟悉常见物质的分离方法,题目难度中等.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
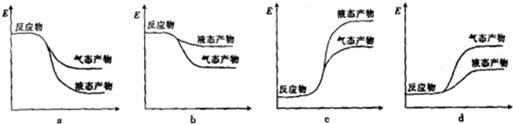
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).

| A. | 用装置甲制取二氧化硫气体 | |
| B. | 用装置乙收集二氧化硫气体 | |
| C. | 用适量CuO粉末中和反应后溶液,用装置丙过滤 | |
| D. | 用装置丁蒸发浓缩CuSO4溶液 |
①CO(g)+H2(g)═CH3OH(g)△H1
②CO2(g)+H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C$\stackrel{←}{=}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
(2)反应①的化学平衡常数K的表达式为K=$\frac{c(CH{\;}_{3}OH)}{c(CO)×c{\;}^{2}(H{\;}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
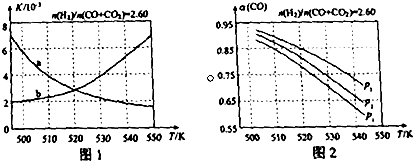
(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.CO平衡转化率a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.
| A. | 10mol | B. | 0.1mol | C. | 1mol | D. | 100mol |
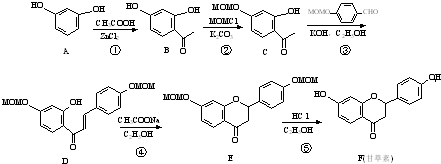
 的合成路线如图(部分反应条件省略)
的合成路线如图(部分反应条件省略)
 (注明反应的条件).
(注明反应的条件). .
.
 的分子式为C10H16O;其含有的含氧官能团名称是醛基.
的分子式为C10H16O;其含有的含氧官能团名称是醛基. .
. .生成B物质的反应类型为:取代反应.
.生成B物质的反应类型为:取代反应.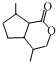 的同分异构体
的同分异构体 .(任写一种)
.(任写一种)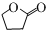 的合成路线图(无机试剂任选),合成路线流程图如下:
的合成路线图(无机试剂任选),合成路线流程图如下:
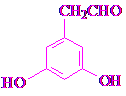 (任写一种).
(任写一种).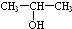 和HCHO为原料制备
和HCHO为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: