题目内容
14.硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4═H++HSO4-,HSO4-?H++SO42-.请回答下列有关问题:
(1)Na2SO4溶液呈弱碱性(填“弱酸性”、“中性”或“弱碱性”),其理由是SO42-+H2O═HSO4-+OH-.(用离子方程式表示).
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为Ba2++HSO4-═BaSO4↓+H+.
(3)在0.10mol•L-1的Na2SO4溶液中,下列离子浓度的关系正确的是BCD(填写编号).
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)若25℃时,0.10mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则0.10mol•L-1的H2SO4溶液中c(SO42-)<0.029mol•L-1(填“<”、“>”或“=”),其理由是H2SO4═HSO4-+H+,电离出的H+抑制HSO4-的电离.
(5)或25℃时,0.10mol•L-1H2SO4溶液的pH=-lg 0.11,则0.10mol•L-1H2SO4溶液中c(SO42-)=0.01 mol•L-1.
分析 硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-.
(1)Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性;
(2)根据硫酸溶液中存在HSO4-离子书写离子方程式;
(3)在0.10mol•L-1的Na2SO4溶液中离子浓度关系:
A、溶液中硫酸完全电离分析;
B、依据溶液中存在质子守恒为;
C、依据溶液中存在电荷守恒分析;
D、依据物料守恒分析判断;
(4)依据硫酸在水中的第一步电离是完全的,第二步电离并不完全,结合平衡移动分析判断;
(5)依据氢离子浓度对硫酸氢根离子的电离平衡影响分析判断.
解答 解:根据硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-,则
(1)Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性,故答案为:弱碱性;SO42-+H2O?OH-+HSO4-;
(2)硫酸溶液中存在HSO4-离子,难电离,硫酸与氯化钡溶液反应的离子方程式为:HSO4-+Ba2+=BaSO4↓+H+,故答案为:HSO4-+Ba2+=BaSO4↓+H+;
(3)在0.10mol•L-1的Na2SO4溶液中离子浓度关系:
A、溶液中硫酸完全电离,故A错误;
B、溶液中存在质子守恒为:c(OH-)=c( HSO4-)+c(H+),故B正确;
C、溶液中存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),故C正确;
D、依据物料守恒,c( Na+)=2c(SO42-)+2c(HSO4-),故D正确;
故选BCD;
故答案为:BCD;
(4)25℃时,0.10mol•L-1的NaHSO4溶液中c( SO42-)=0.029mol•L-1,H2SO4═HSO4-+H+,则0.10mol•L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c( SO42-)<0.029mol•L-1,
故答案为:<;硫酸溶液中氢离子浓度大,对硫酸氢根离子电离平衡起到抑制作用;
(5)若25℃时,0.10mol•L-1H2SO4溶液的pH=-lgO.11,C(H+)=0.11mol/L;依据:①H2SO4=H++HSO4-,②HSO4-?H++S042-.①电离出的氢离子浓度为0.10mol/L;所以②电离出的氢离子浓度为0.11mol/L-0.1.mol/L=0.01mol/L;则0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L,
故答案为:0.01mol/L.
点评 本题考查电解质的电离和离子方程式的书写,溶液中电荷守恒应用,物料守恒的应用,题目难度中等,本题注意把握题意,突破硫酸为二元强酸的思维,从题目实际出发,加强自学能力的培养.

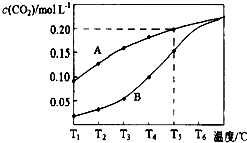 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)=CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:(1)该反应正反应为吸热反应(填吸或放),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为0.2.
(2)如果该反应的平衡常数K值变大,该反应bc(选填编号).
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:随着温度升高,反应速率加快,达到平衡所需要的时间变短.
| 物质 | 电离平衡常数(25℃) |
| C6H5OH | Ki=1.28×10-10 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
(5)已知苯酚和碳酸的电离平衡常数如图所示请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式C6H5O-+CO2+H2O→C6H5OH+HCO3-,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据二氧化碳与水结合生成碳酸,且碳酸酸性比苯酚酸性强,故能生成苯酚.碳酸的电离分两步:第一步:H2CO3?H++HCO3-,该步电离出的H+更容易结合C6H5O-生成酸性更弱的C6H5OH,导致第一步电离平衡正向移动,第二步电离:HCO3-?H++CO32-,C6H5OH酸性大于HCO3-,所以第二步电离出的H+更容易结合CO32-而不容易结合C6H5O-,故不影响第二步电离平衡.
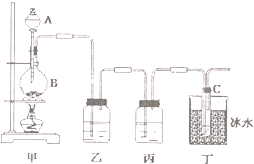 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题: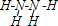 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.


 的分子式为C10H16O;其含有的含氧官能团名称是醛基.
的分子式为C10H16O;其含有的含氧官能团名称是醛基. .
. .生成B物质的反应类型为:取代反应.
.生成B物质的反应类型为:取代反应.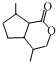 的同分异构体
的同分异构体 .(任写一种)
.(任写一种)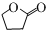 的合成路线图(无机试剂任选),合成路线流程图如下:
的合成路线图(无机试剂任选),合成路线流程图如下:
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: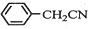 +HO2+H2SO4$\stackrel{100-130℃}{→}$
+HO2+H2SO4$\stackrel{100-130℃}{→}$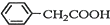 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→( )2Cu+H2O
)2Cu+H2O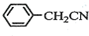 )到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(
)到硫酸溶液中,然后升温至130℃继续反应,仪器c的名称是球形冷凝管.反应结束后加适量冷水,再分离出苯乙酸(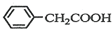 )粗品.加入冷水的目的是便于苯乙酸析出.
)粗品.加入冷水的目的是便于苯乙酸析出.