题目内容
11.下列反应的离子方程式中正确的是( )| A. | 碳酸氢钠溶液和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 碳酸钾溶液与稀硫酸反应:CO32-+H+═CO2↑+H2O | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 实验室制取氧气:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2K++2Cl-+3O2↑ |
分析 A.碳酸氢根离子不能拆开,需要保留整体形式;
B.离子方程式两边总电荷不相等;
C.钠与水反应生成氢氧化钠和氢气;
D.氯酸钾的分解反应不是发生在溶液中的反应,不能书写离子方程式.
解答 解:A.碳酸氢根离子不能拆开,正确的离子方程式为:HCO3-+H+═H2O+CO2↑,故A错误;
B.碳酸钾溶液与稀硫酸反应的离子方程式为:CO32-+2H+═CO2↑+H2O,故B错误;
C.钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故C正确;
D.氯酸钾的分解反应为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,该反应不是发生在溶液中的反应,不能书写离子方程式,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等,试题培养了学生的灵活应用能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
1.t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)?2Z(g),各组分在不同时刻的浓度如表:下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 | |
| D. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |

 的合成路线如图(部分反应条件省略)
的合成路线如图(部分反应条件省略)
 (注明反应的条件).
(注明反应的条件). .
.
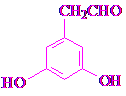
 的分子式为C10H16O;其含有的含氧官能团名称是醛基.
的分子式为C10H16O;其含有的含氧官能团名称是醛基. .
. .生成B物质的反应类型为:取代反应.
.生成B物质的反应类型为:取代反应.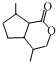 的同分异构体
的同分异构体 .(任写一种)
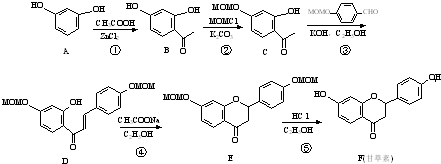
.(任写一种) 的合成路线图(无机试剂任选),合成路线流程图如下:
的合成路线图(无机试剂任选),合成路线流程图如下:
 (任写一种).
(任写一种).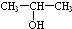 和HCHO为原料制备
和HCHO为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: