题目内容
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)B中所发生反应的离子方程式为___。
(2)洗气装置C中所放试剂为饱和食盐水,其作用是___,D中所放试剂为紫色石蕊试液,可观察到的现象为___,产生该现象的原因是氯气与水发生了反应,反应的离子方程式为___。
(3)E中为红色干布条,F中为红色湿布条,用以验证干燥的氯气是否具有漂白性,实验设计是否合理___(填“是”或“否”),若不合理应如何改进?(认为合理则此问不用做答)___。
(4)G是浸有淀粉KI溶液的棉花球,可观察到的现象是棉花球表面变成___,H是浸有NaBr溶液的棉花球,该处反应的化学方程式为___。
(5)P为尾气吸收装置,所需试剂为__(填化学式)溶液。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去Cl2中的HCl 先变红后褪色 Cl2+H2O
Mn2++Cl2↑+2H2O 除去Cl2中的HCl 先变红后褪色 Cl2+H2O![]() H++Cl-+HClO 否 在D与E之间添加盛有浓硫酸的洗气瓶 蓝色 Cl2+NaBr=2NaCl+Br2 NaOH
H++Cl-+HClO 否 在D与E之间添加盛有浓硫酸的洗气瓶 蓝色 Cl2+NaBr=2NaCl+Br2 NaOH
【解析】
(1)分析装置图中仪器作用,写出化学方程式;
(2)浓盐酸易挥发,从发生装置中制取的氯气,含有杂质氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢极易溶于水,可用饱和食盐水吸收氯化氢。氯气与水反应,生成氯化氢和次氯酸,氯水具有漂白性;
(3)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性;
(4)氯气具有强氧化性,能够氧化碘离子,单质碘遇到淀粉变蓝;
(5)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收氯气。
(1)B中加入浓盐酸和二氧化锰,加热反应生成氯气化学方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故本题答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故本题答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)从发生装置出来的氯气中含有杂质HCl和水蒸气,通过盛有饱和食盐水的洗气瓶除去HCl,在D中氯气和水反应,生成了盐酸和次氯酸,可观察到颜色变化为先变红后褪色,发生的反应为:Cl2+H2O![]() H++Cl-+HClO,故本题答案为:除去Cl2中的HCl;先变红后褪色;Cl2+H2O
H++Cl-+HClO,故本题答案为:除去Cl2中的HCl;先变红后褪色;Cl2+H2O![]() H++Cl-+HClO;
H++Cl-+HClO;
(3)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,所以氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色,但是氯气从B产生后,未经干燥,装置中含有水蒸气,所以不能验证干燥的氯气是否具有漂白性,若要验证,要在D与E之间添加盛有浓硫酸的洗气瓶,故本题答案为:否;在D与E之间添加盛有浓硫酸的洗气瓶;
(4)氯气和碘化钾溶液中的碘离子反应生成碘单质。碘遇到淀粉变蓝;Cl2也能将Br-氧化为Br2,离子方程式为:Cl2+NaBr=2NaCl+Br2,故本题答案为:蓝色;Cl2+NaBr=2NaCl+Br2;
(5)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠来吸收,故本题答案为:NaOH。

 阅读快车系列答案
阅读快车系列答案【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
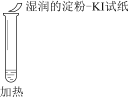
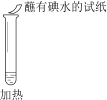
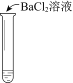
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化