题目内容
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是________。
a. 用熟石灰处理废水中的酸
b. 用臭氧处理废水中的氰化物
c. 用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a. 作物秸杆露天焚烧
b. 废干电池就地填埋
c. 废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
①属于人体所需微量元素的是________。
②属于脂溶性维生素的是________。
③可为人体提供能量的是________、________和________。
(3)材料的发展与应用促进了人类社会的进步。
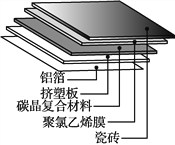
①碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是________;属于硅酸盐材料的是________;属于高分子材料的是挤塑板和________。
②吸附材料具有多孔、表面积大的特点。活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体。写出该反应的化学方程式:_________________________________________。
③LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_______________________________________。
【答案】 c a b 铁 维生素A 糖类 蛋白质 脂肪 铝箔 瓷砖 聚氯乙烯膜 2C+2NO2===2CO2+N2 8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑
4LiMn2O4+2CO2↑+O2↑
【解析】(1)①SO2气体的排放会导致酸雨形成,答案选c;②a. 用熟石灰处理废水中的酸属于中和法,a正确;b. 用臭氧处理废水中的氰化物发生氧化还原反应,b错误;c. 用铁粉回收废水中的铜发生氧化还原反应,c错误;答案选a;③a. 作物秸杆露天焚烧会造成大气污染,a错误;b. 废干电池就地填埋造成土壤重金属污染,b正确;c. 废旧塑料随意丢弃会造成白色污染,c错误,答案选b;(2)①属于人体所需微量元素的是铁。②属于脂溶性维生素的是维生素A。③可为人体提供能量的是蛋白质、脂肪、糖类。(3)①铝箔属于金属材料;瓷砖属于硅酸盐材料;挤塑板、聚氯乙烯膜属于高分子材料。②活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体,根据原子守恒可知应该是氮气和二氧化碳,该反应的化学方程式为2C+2NO2=2CO2+N2。③LiMn2O4可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质,根据化合价变化可判断单质应该是氧气,即氧元素失去电子,该反应的化学方程式为8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑。
4LiMn2O4+2CO2↑+O2↑。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。