题目内容
【题目】下列电离方程式正确的是
A.硫化氢溶于水:H2S![]() 2H++S2-
2H++S2-
B.熔融状态下的NaHSO4:NaHSO4=Na++H++SO42-
C.碳酸氢钠溶于水:NaHCO3=HCO3-+Na+
D.醋酸溶于水:CH3COOH=CH3COO-+H+
【答案】C
【解析】
A.硫化氢溶于水后得到的氢硫酸是二元弱酸,分步电离,电离方程式为:H2S![]() H++HS-,A错误;
H++HS-,A错误;
B.熔融状态下NaHSO4电离产生Na+、HSO4-,电离方程式为:NaHSO4=Na++HSO4-,B错误;
C.碳酸氢钠溶于水电离产生Na+、HCO3-,电离方程式为:NaHCO3=HCO3-+Na+,C正确;
D.醋酸是一元弱酸,在溶液中存在电离平衡,电离方程式为:CH3COOH![]() CH3COO-+H+,D错误;
CH3COO-+H+,D错误;
故合理选项是C。

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
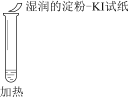
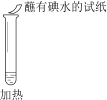
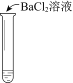
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化