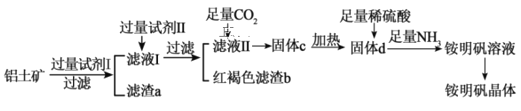
题目内容
【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
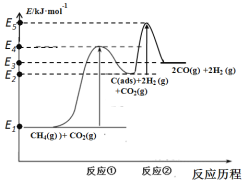
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
【答案】![]() 放出 46kJ b
放出 46kJ b ![]() <
<
【解析】
(1)根据化学反应速率之比等于物质对应计量数之比可知,0~50s内的平均反应速率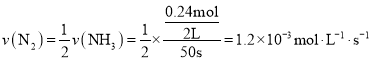 ;
;
(2)该反应中反应物总键能为(3×436+946)kJ/mol=2254 kJ/mol,生成物的总键能为6×391 kJ/mol=2346 kJ/mol,反应物总键能小于生成物总键能,由此可知,生成2molNH3时,放出(2346-2254) kJ=92 kJ能量,则生成1molNH3过程中放出能量为![]() ;
;
(3)a.降低温度会使化学反应速率降低,故a不符合题意;
b.增大压强能够增大化学反应速率,故b符合题意;
c.恒容时充入He气,各组分的浓度未发生改变,化学反应速率不变,故c不符合题意;
d.恒压时充入He气,容器体积将增大,各组分浓度将减小,化学反应速率将减小,故d不符合题意;
e.及时分离NH3,将使体系内压强降低,化学反应速率将减小,故e不符合题意;
故答案为:b;
(4)由图可知,1molCH4(g)与1molCO2(g)的总能量为E1kJ,2molCO(g)与2molH2(g)的总能量为E3kJ,生成物总能量高于反应物总能量,该反应为吸热反应,则由CH4与CO2制备“合成气”的热化学方程式为:![]() ;反应①为慢反应,反应②为快反应,由此可知反应①的活化能大于反应②的活化能,即E4-E1>E5-E2,故E5+E1<E4+E2。
;反应①为慢反应,反应②为快反应,由此可知反应①的活化能大于反应②的活化能,即E4-E1>E5-E2,故E5+E1<E4+E2。

【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:![]()
![]()
![]()
下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 |
|
|
|
K |
|
|
|
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”).某温度下,将2molCO和6mol![]() 充入2L的密闭容器中,充分反应,达到平衡后,测得
充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
(2)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有![]() 时,实验室利用如图装置模拟该法:
时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ______ .
②请完成电解池中![]() 转化为
转化为![]() 的离子反应方程式:______
的离子反应方程式:______![]() +______
+______ ![]() ______ = ______
______ = ______ ![]() +______
+______![]() ______
______
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______.(已知,
______.(已知,![]() ,
,![]() )
)