题目内容
【题目】工业上以铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)为原料制取铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
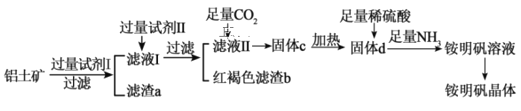
请回答下列问题:
(1)试剂I为__________;试剂Ⅱ为____________;滤渣a的化学式为__________。
(2)证明铁元素已全部转化为滤渣b的实验方法是_______________________________。
(3)滤液Ⅱ中通入足量CO2进行酸化,从而得到固体c,若用盐酸进行酸化是否可以?____,请说明理由:___________________________________________________________。
(4)由固体d制取铵明矾溶液的化学方程式为________________________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)蒸发浓缩、冷却结晶、_______________。
【答案】盐酸(或稀硫酸等) NaOH溶液(或KOH溶液等) SiO2 取少量滤液Ⅱ于小试管中,向小试管中滴加KSCN溶液,若溶液不变红,说明Fe3+已全部转化为红褐色滤渣b 不可以 通入足量CO2进行酸化的目的是使滤液Ⅱ中的AlO2ˉ转化为Al(OH)3,而Al(OH)3能溶于盐酸,不易控制加入盐酸的量,故不能用盐酸进行酸化 Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O 过滤洗涤干燥
【解析】
根据滤液I处理后,会出现红褐色滤渣,可判断滤液I中存在铁离子,所以试剂I为过量的强酸,滤渣a为二氧化硅,过量试剂II为强碱,滤液中含有偏铝酸根,滤渣b为氢氧化铁,向滤液II中通入二氧化碳,得到固体c为氢氧化铝,加热后得到氧化铝。
(1)试剂I为盐酸(或稀硫酸等);试剂Ⅱ为NaOH溶液(或KOH溶液等);滤渣a的化学式为SiO2;
(2)证明铁元素已全部转化为滤渣b,即要证明溶液中不存在铁离子,实验方法是取少量滤液Ⅱ于小试管中,向小试管中滴加KSCN溶液,若溶液不变红,说明Fe3+已全部转化为红褐色滤渣b;
(3)不可以使用盐酸,通入足量CO2进行酸化的目的是使滤液Ⅱ中的AlO2ˉ转化为Al(OH)3,而Al(OH)3能溶于盐酸,不易控制加入盐酸的量,故不能用盐酸进行酸化;
(4)由固体d制取铵明矾溶液的化学方程式为Al2O3+4H2SO4+2NH3=2NH4Al(SO4)2+3H2O,从溶液中得到晶体的方法为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
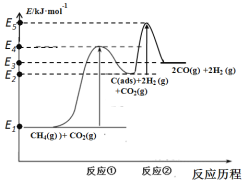
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。


