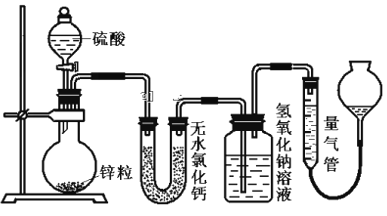
题目内容
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B. 向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失:2H++SiO32-=H2SiO3(胶体)
C. 惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+
【答案】B
【解析】
A.漂白粉在空气中失效是漂白粉的有效成分Ca(ClO)2和空气中的CO2和水作用,由于反应在空气中进行,不是在水溶液中进行,所以不能写离子方程式,故A不选;
B.硅酸钠溶液显碱性,滴入酚酞显红色,滴加盐酸,SiO32-和H+结合为H2SiO3胶体,溶液碱性减弱,红色变浅甚至接近消失,故B选;
C.生成的OH-会和溶液中的Mg2+结合生成Mg(OH)2沉淀,故C不选;
D.溶液是强碱性的,不能生成H+,故D不选。
故选B。

【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
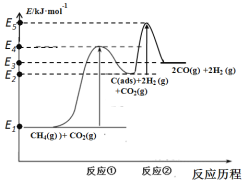
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
【题目】“低碳经济”已成为全世界科学家研究的重要课题,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L-2。
(2)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3)∶c(CO32 -)=2∶1,溶液pH=____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中阴离子的浓度由大到小的顺序为______________
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______极,该电极反应式是___________________________________
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g) + Y(g)![]() Z(g)。反应过程中测定的部分数据如下表:
Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A. 反应1~2min末的平均速率v(Z)=0.2mol/(L·min)
B. 在2min~4min间,v(X)正>v(Y)逆
C. 生成1mol Z的同时,生成1mol X能说明该反应已达化学平衡状态
D. 其他条件不变,再充入1.2mol X,X的转化率将增大