题目内容
【题目】对H2O的电离平衡不产生影响的粒子是
A. ![]() B. 26Fe3+ C.
B. 26Fe3+ C.  D. CH3COO-
D. CH3COO-
【答案】C
【解析】
A.HCl溶于水电离产生H+,对水的电离平衡起抑制作用,故A错误;
B.26Fe3+在水中发生水解反应:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,由于消耗了水电离产生的OH-,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡,故B错误
Fe(OH)3(胶体)+3H+,由于消耗了水电离产生的OH-,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡,故B错误
C.Cl-既不会和H+发生作用,也不会与OH-发生反应,因此对水的电离平衡无影响,故C正确;
D.CH3COO-是弱酸根,会发生水解反应:CH3COO-+H2O![]() CH3COOH+OH-,由于消耗了水电离产生的H+,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡,故D错误。
CH3COOH+OH-,由于消耗了水电离产生的H+,促进了水的电离,所以水的电离平衡正向移动,直至达到新的平衡,故D错误。
故选C。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
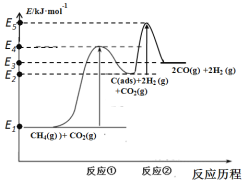
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。