题目内容
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:![]()
![]()
![]()
下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 |
|
|
|
K |
|
|
|
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”).某温度下,将2molCO和6mol![]() 充入2L的密闭容器中,充分反应,达到平衡后,测得
充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
,则CO的转化率为 ______ ,此时的温度为 ______(从表中选择).
(2)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有![]() 时,实验室利用如图装置模拟该法:
时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ______ .
②请完成电解池中![]() 转化为
转化为![]() 的离子反应方程式:______
的离子反应方程式:______![]() +______
+______ ![]() ______ = ______
______ = ______ ![]() +______
+______![]() ______
______
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______.(已知,
______.(已知,![]() ,
,![]() )
)
【答案】放 80% 250℃ O2+4e-+4H+=2H2O 1;6;14H+;2;6;7H2O 5.6
【解析】
(1)根据图表中的数据可知,化学平衡常数随温度的升高而降低,再根据平衡移动原理进行解题;根据三段式进行解题即可,化学平衡常数等于生成物系数次方的乘积比上反应物系数次方的乘积;
(2)①由图可知图左侧装置为甲醇燃料电池,氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,负极电极反应式为:CH3OH﹣6e﹣+H2O=6H++CO2↑,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水,正极电极反应式为:O2+4e-+4H+=2H2O;右侧装置为电解酸性含铬废水装置,与原电池正极相连的电极为电解池阳极,与原电池负极相连的电极为电解池阴极,据此解题;
②根据氧化还原反应中得失电子守恒进行配平即可;
(3)根据题中给出的溶度积Ksp=c(Cr3+)×c3(OH﹣)进行计算;
(1)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol):1 3 0
变化浓度(mol):0.8 1.6 0.8
平衡浓度(mol):0.2 1.4 0.8
CO转化率=0.8mol÷1mol×100%=80%,平衡常数K=c(CH3OH)/[c(CO)c2(H2)]=0.8÷(0.2×1.42)=2.041,故温度为250℃;
(2)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,负极电极反应式为:CH3OH﹣6e﹣+H2O=6H++CO2↑,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水,正极电极反应式为:O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
②电解池溶液里Cr2O72﹣转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72﹣还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72﹣的系数为1,Fe2+的系数为6,反应离子方程式为:Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:1;6;14H+;2;6;7H2O;
(3)Ksp=c(Cr3+)×c3(OH﹣)=6.4×10-31,c(Cr3+)=1×10-5mol·L﹣1 时,溶液中c(OH﹣)=4×10-9mol·L﹣1,则c(H+)=![]() =2.5×10-6mol·L﹣1,则pH=﹣lg2.5×10-6=5.6。
=2.5×10-6mol·L﹣1,则pH=﹣lg2.5×10-6=5.6。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
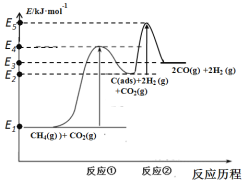
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。



