题目内容
【题目】现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法正确的是
A.简单阳离子的氧化性:![]()
B.气态氢化物的沸点:![]()
C.X、Z与M不可能存在同一离子化合物中
D.Y2Z的溶液:c(Y+):c(Z2-) > 2:1
【答案】D
【解析】
短周期元素X、Y、Z、M,X与Z、M都不在同一周期,Z、M位于同主族,说明X为H,Z的核电荷数是M的2倍,说明Z为S,M为O,X、Y位于同主族,Y、Z位于同周期,说明Y为Na。
A. 金属性越强,其阳离子的氧化性越弱,因此简单阳离子的氧化性:H+ > Na+,故A错误;
B. 水存在分子间氢键,因此气态氢化物的沸点:H2O > H2S,故B错误;
C. X、Z与M可能存在同一离子化合物中,比如硫酸氢钠,故C错误;
D. 硫化钠溶液中硫离子水解,因此c(Na+):c(S2-) > 2:1,故D正确。
综上所述,答案为D。

【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
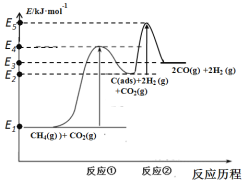
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
【题目】工业酸性废水中的![]() 可转化为
可转化为![]() 除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为
除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为![]() 的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )
的起始浓度、电压、电解时间均相同),下列说法中,不正确的是( )
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨,滴加 | 阴极为石墨,阳极为铁,滴加 |
| 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高![]() 的去除率
的去除率
B. 实验②中,![]() 在阴极放电的电极反应式是
在阴极放电的电极反应式是![]()
C. 实验③中,![]() 去除率提高的原因是阳极产物还原
去除率提高的原因是阳极产物还原![]()
D. 实验③中,理论上电路中每通过![]() 电子,则有
电子,则有![]()
![]() 被还原
被还原