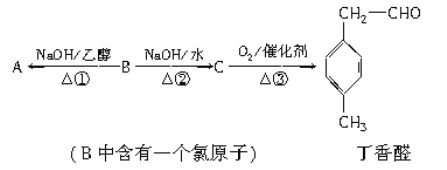
题目内容
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5 表示。有关说法正确的是

A. 该装置为原电池,b为原电池的负极
B. 中间室Na+移向右室,Cl-移向左室,a极区溶液的pH减小
C. 当左室有4.48L(标准状况下)CO2生成时,右室产生的N2为0.8mol
D. b电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
【答案】B
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10 e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O===6CO2↑+24H+。
A.该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,故A错误;
B.a是负极,中间室Na+移向右室,Cl-移向左室,电极反应式为C6H10O5-24e-+7H2O===6CO2↑+24H+,所以a极区溶液的pH减小,故B正确;
C.根据分析列关系式2N2~5CO2,n(N2)=![]() ×n(CO2)=
×n(CO2)=![]() ×
×![]() =0.08mol,故C错误;
=0.08mol,故C错误;
D.电极b是正极,电极反应式为2NO3-+10 e-+12H+=N2↑+6H2O,故D错误;
正确答案:B。

 字词句段篇系列答案
字词句段篇系列答案【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
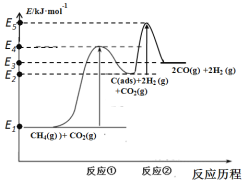
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g) + Y(g)![]() Z(g)。反应过程中测定的部分数据如下表:
Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A. 反应1~2min末的平均速率v(Z)=0.2mol/(L·min)
B. 在2min~4min间,v(X)正>v(Y)逆
C. 生成1mol Z的同时,生成1mol X能说明该反应已达化学平衡状态
D. 其他条件不变,再充入1.2mol X,X的转化率将增大