题目内容
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908 kJ·mol-1
请写出氨气被一氧化氮氧化生成无毒气体的热化学方程式:___________。
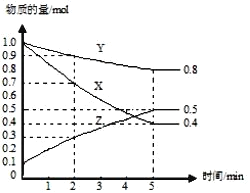
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。
2NH3(g) ΔH=-92.4 kJ·mol-1。下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。

①已知图甲中0~t1 min内,v(H2)=0.03 mol·L-1·min-1,则t1=________ min;若从t2 min起仅改变一个反应条件,则所改变的条件可能是____________________________(填一种即可)。
②图乙中,b点时k=_________。
③已知某温度下该反应的平衡常数K=10,在该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1 mol/L,c(N2)=0.5 mol/L,c(NH3)=0.1 mol/L,则在平衡建立过程中NH3的浓度变化趋势是__________(填“逐渐增大”“逐渐减小”或“恒定不变”)。
(3)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似,是一种应用广泛的化工原料,可用作火箭燃料。(已知:N2H4+H+![]() N2H5+)
N2H5+)
①N2H5+的电子式为_______。联氨与硫酸形成的酸式盐的化学式为________。
②联氨是一种常用的还原剂。向装有少量AgCl的试管中加入联氨溶液,观察到的现象___________________________________________________________。
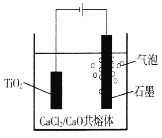
(4)尿素(CO(NH2)2)是目前使用量较大的一种化学氮肥,工业上利用下图所示装置(阴、阳极均为惰性电极)电解尿素的碱性溶液制取氢气。
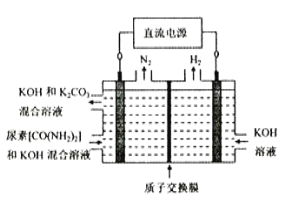
①该装置中阳极的总电极反应式为_____________________________________________。
②若两极共收集到气体22.4L(标准状况),则消耗的尿素为____________g(忽略气体的溶解)。
【答案】4NH3(g) + 6NO(g)=5N2(g) + 6H2O(g) ΔH=-1808 kJ·mol-1 30 降低温度(或增大H2浓度、减小NH3浓度) 3:1 逐渐减小 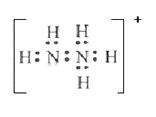 N2H6(HSO4)2 固体逐渐变黑,并有气泡产生 CO(NH2)2+8OH--6e-===N2↑+CO32—+6H2O 15
N2H6(HSO4)2 固体逐渐变黑,并有气泡产生 CO(NH2)2+8OH--6e-===N2↑+CO32—+6H2O 15
【解析】
(1)由盖斯定律计算可得;
(2)①由速率之比等于化学计量数之比,然后根据速率的计算公式求出时间。根据影响化学平衡的因素来解答;
②当N2与H2的起始体积比符合方程式中化学计量数之比时,达到平衡时氨的体积分数最大;
③根据浓度商和化学平衡常数比较,判断化学平衡移动方向,进而判断平衡建立过程中NH3的浓度变化趋势;
(3)①N2H4是二元弱碱,其性质与氨气相似,第一步电离出1个氢氧根离子和N2H5+,则第二步中N2H5+电离出1个氢氧根离子和N2H62+;
(1)令①:N2(g)+O2(g)=2NO(g) △H=+180 kJ·mol-1,②:4NH3(g)+5O2(g) =4NO(g)+6H2O(g) △H= -908 kJ·mol-1,氨气被一氧化氮氧化生成无毒气体的化学方程式为③:4NH3(g) + 6NO(g)=5N2(g) + 6H2O(g),③=②-5![]() ①,△H=(-908-5
①,△H=(-908-5![]() 180)kJ·mol-1=-1808 kJ·mol-1,则氨气被一氧化氮氧化生成无毒气体的热化学方程式4NH3(g) + 6NO(g)=5N2(g) + 6H2O(g) ΔH=-1808 kJ·mol-1;
180)kJ·mol-1=-1808 kJ·mol-1,则氨气被一氧化氮氧化生成无毒气体的热化学方程式4NH3(g) + 6NO(g)=5N2(g) + 6H2O(g) ΔH=-1808 kJ·mol-1;
(2)①0~t1 min内,v(H2)=0.03 mol·L-1·min-1,,v(N2)=0.01 mol·L-1·min-1,则![]() =
=![]() =0.01 mol·L-1·min-1,解得t1=30min。从t2 min起N2的浓度逐渐减小,则所改变的条件可能是降低温度(或增大H2浓度、减小NH3浓度)使得平衡正向移动引起的;
=0.01 mol·L-1·min-1,解得t1=30min。从t2 min起N2的浓度逐渐减小,则所改变的条件可能是降低温度(或增大H2浓度、减小NH3浓度)使得平衡正向移动引起的;
②当N2与H2的起始体积比符合方程式中化学计量数之比时,达到平衡时氨的体积分数最大,即图乙中,b点时k=3:1;
③c(H2)=0.1 mol/L,c(N2)=0.5 mol/L,c(NH3)=0.1 mol/L,则Qc= =
=![]() =20>10,所以反应逆向进行,NH3的浓度逐渐减小;
=20>10,所以反应逆向进行,NH3的浓度逐渐减小;
(3)①N2H4是二元弱碱,其性质与氨气相似,第一步电离出1个氢氧根离子和N2H5+,则第二步中N2H5+电离出1个氢氧根离子和N2H62+。N2H5+的电子式为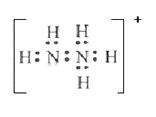 。N2H4是二元弱碱,其性质与氨气相似,第一步电离出1个氢氧根离子和N2H5+,则第二步中N2H5+电离出1个氢氧根离子和N2H62+,则联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2;
。N2H4是二元弱碱,其性质与氨气相似,第一步电离出1个氢氧根离子和N2H5+,则第二步中N2H5+电离出1个氢氧根离子和N2H62+,则联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2;
②Nspan>2H4被银离子氧化,银离子被还原生成单质银,-2价的N元素被氧化为N2,反应方程式为:N2H4+4AgBr=4Ag↓+N2↑+4HBr,因此反应出现现象为:固体逐渐变黑,并有气泡产生;
(4)①阳极化合价升高失去电子,发生氧化反应,CO(NH2)2被氧化为N2,在碱性条件下产生碳酸根离子,则该装置中阳极的总电极反应式为CO(NH2)2+8OH--6e-=N2↑+CO32—+6H2O;
②该电解池总反应式为:CO(NH2)2+2OH-=N2↑+CO32—+3H2↑,若两极共收集到气体22.4L(标准状况),即1mol气体,其中氮气和氢气的物质的量之比为1:3,故氮气有0.25mol,CO(NH2)2的物质的量也为0.25mol,则消耗的尿素为0.25mol ![]() 15g。
15g。

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案