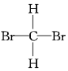
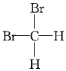
题目内容
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
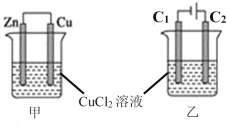
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
【答案】氧化 Zn Zn-2e-=Zn2+ 3.2g 阴 有红色物质析出 2Cl--2e-=Cl2↑ 4.48L
【解析】
(1)活泼金属锌为负极,原电池中阴离子向负极移动,根据转移电子守恒分析解答;
(2)石墨电极C1与电源的负极相连作阴极,溶液中铜离子在阴极上放电生成单质铜,C2极与电源的正极连接,作阳极,氯离子失去电子,发生氧化反应,先计算12.8g的Cu的物质的量,然后根据同一闭合回路中转移电子相同,计算阳极产生的氯气的物质的量,由此分析解答。
(1)在甲装置中,Zn电极发生氧化反应,溶液中Cl-向正电荷较多的负极Zn移动,负极Zn失去电子,发生氧化反应,负极的电极反应式为Zn-2e-=Zn2+;若反应过程中有0.1mol电子发生转移,根据同一闭合回路中电子转移数目相等,可知在正极Cu上生成铜的物质的量为n(Cu)=0.1mol÷2=0.05mol,则Cu极质量增加m(Cu)=0.05mol×64g/mol=3.2g;
(2)石墨电极C1与电源的负极相连,作阴极,根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中Cu2+在阴极C1放电生成单质铜,因此看到的C1电极上的现象为有红色物质析出;C2极与电源的正极连接,作阳极,溶液中的阴离子Cl-失去电子,发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,12.8g的Cu的物质的量n(Cu)=12.8g÷64g/m=0.2mol,则转移电子的物质的量为n(e-)=2×0.2mol=0.4mol,则阳极产生的氯气的物质的量n(Cl2)=0.2mol,其标准状况下体积为V(Cl2)=n(Cl2)Vm=0.2mol×22.4L/mol=4.48L。