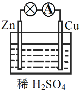
��Ŀ����
����Ŀ������Ϊ��ѧ��ѧ�г��������ʣ���Cu�� ��FeCl3��Һ�� ��CuCl2��Һ����CO2����H2SO4���ƾ�����CaCO3����FeSO4����Ba(OH)2��
�����Ҫ��ش������й����⣺
��1���������������ڵ���ʵ���________�����ڷǵ���ʵ���__________��������ţ�
��2�����ڢۢ������Ƴ�Ũ�Ⱦ�Ϊ1molL��1�Ļ����Һ100mL������һ���������ۣ���ַ�Ӧ����������ʣ�࣬����ͭ���ɣ���Ӧ�����Һ��һ�����е���������______��������Ӧ�����ӷ���ʽΪ_____________________________________________________��
��3���������Һ�������ӵ��Լ���________________��֤������ڵ�������____________��
��4�����ˮ����εμ�1 mol��L��1 FeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵ������ֱ���ķ�Χ��________ nm��
���𰸡��ݢߢ�� �ܢ� Fe2+����дH+Ҳ�ɣ� 2Fe3++Fe��3Fe2+ Fe+ Cu2+�� Fe2++ Cu KSCN��Һ ��Һ��� 1~100nm
��������
��ˮ��Һ�������״̬���ܹ�����Ļ������������ʣ��ᡢ��ζ��ǵ���ʣ���ˮ��Һ�������״̬�¶����ܵ���Ļ�����зǵ���ʡ��ݴ˷�����
(1)��ˮ��Һ�������״̬���ܹ�����Ļ������������ʣ��ᡢ��ζ��ǵ���ʣ���ˮ��Һ�������״̬�¶����ܵ���Ļ�����зǵ���ʡ���C u�ǵ��ʣ����ʼȲ��ǵ����Ҳ���Ƿǵ�������ں͢۶�����Һ����Һ�ǻ��������Ȳ��ǵ����Ҳ���Ƿǵ��������CO2��ˮ��Һ�����ܵ��磬����������Ӳ���CO2�������������ʵ����H2CO3��Һ���磬��ʵ��Һ̬��CO2�����磬����CO2�Ƿǵ��������H2SO4���ᣬ���ڵ�������ƾ���ˮ��Һ��ʹ�Һ̬ʱ�������磬���Ծƾ����ڷǵ��������CaCO3���Σ����ڵ��������FeSO4���Σ����ڵ��������Ba(OH)2�Ǽ���ڵ�������𰸣����ڵ���ʵ��Ǣݢߢ�ᣬ���ڷǵ�����Ǣܢޣ�
(2)������֪�����Ƶ���Һ�к�Fe3+��Fe2+��Cu2+�������ӣ�����������ǿ����Fe3+>Cu2+>Fe2+����֪�������۷�����Ӧ���Ⱥ�˳���ǣ�2Fe3++Fe=3Fe2+��Cu2++Fe=Cu+Fe2+�����Է�Ӧ����Һ��һ�����е���������Fe2+��
(3)Fe3+��SCN-��Ӧ���ɿ�����ˮ�ĺ�ɫ����Fe(SCN)3��Fe3++3SCN-=Fe(SCN)3�������������������Fe3+�Ĵ��ڣ�������ѡ�Լ���KSCN��Һ��֤��Fe3+���ڵ���������Һ��졣
(4)���ˮ����εμ�1 mol��L��1 FeCl3��Һ����Һ������ĺ��ɫ������ӦΪFe3++3H2O![]() Fe(OH)3(����)+3H+�����ĺ��ɫҺ�����Fe(OH)3���壬���������ֱ���ķ�Χ��1nm~100nm��
Fe(OH)3(����)+3H+�����ĺ��ɫҺ�����Fe(OH)3���壬���������ֱ���ķ�Χ��1nm~100nm��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�