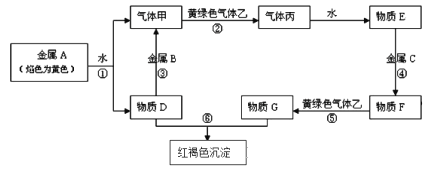
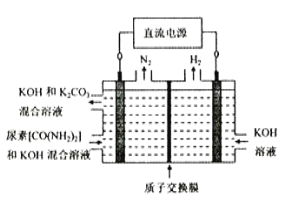
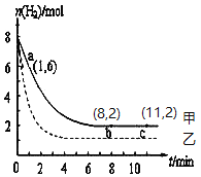
题目内容
【题目】在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和c(H+)都相等,向两烧杯中同时加入两颗锌粒,反应结束后得到等量的氢气,有一个烧杯中有锌粒剩余。下列说法正确的是
A. 两烧杯中参加反应的锌等量
B. 盐酸物质的量浓度比醋酸大
C. 乙烧杯中的锌粒剩余
D. 甲烧杯的反应时间更短
【答案】A
【解析】
A.由题意知反应结束后得到等量的氢气,根据反应方程式2HCl+Zn=ZnCl2+H2↑,2CH3COOH+Zn=(CH3COO)2Zn+ H2↑中计量关系可知,两烧杯中参加反应的锌等量,A正确;
B.因为盐酸和醋酸溶液中c(H+)相同,盐酸完全电离而醋酸部分电离,所以两种酸的物质的量浓度大小关系:c(HCl)<c(CH3COOH),B项错误;
C.据B项分析知两种酸的物质的量浓度大小关系:c(HCl)<c(CH3COOH),等体积两种溶液中酸的物质的量大小关系:n(HCl)<n(CH3COOH),根据2HCl+Zn=ZnCl2+H2↑,2CH3COOH+Zn=(CH3COO)2Zn+ H2↑中化学计量关系可推知,有锌粒剩余的一定是盐酸,即甲烧杯中的锌粒剩余,C项错误;
D.在反应过程中醋酸的电离平衡CH3COOH![]() CH3COO-+H+向右移动,且醋酸的浓度大于盐酸浓度,故反应过程中两种酸溶液中c(H+)大小关系:醋酸>盐酸,所以两种酸与锌反应速率大小关系:醋酸>盐酸,即乙烧杯的反应时间更短,D项错误;答案选A。
CH3COO-+H+向右移动,且醋酸的浓度大于盐酸浓度,故反应过程中两种酸溶液中c(H+)大小关系:醋酸>盐酸,所以两种酸与锌反应速率大小关系:醋酸>盐酸,即乙烧杯的反应时间更短,D项错误;答案选A。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。