题目内容
【题目】钛的电解冶炼法,如图所示。以含少量CaC12的CaO熔融物作为介质,电解时阴极生成的Ca进一步还原TiO2得到钛。下列说法不正确的是
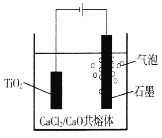
A. Ca还原TiO2的化学方程式为2Ca+TiO2===Ti+2CaO
B. 阳极石墨稳定性强,在实际生产过程中质量几乎不会改变
C. CaC12的作用可能是增强导电性,同时起到助熔剂的作用
D. 已知F=96500C·mol-1,当I=0.5A,通电80分钟,理论上可得Ti的质量为(0.5×80×60×48)/4×96500g
【答案】B
【解析】
A.根据氧化还原反应书写 Ca还原TiO2的化学方程式;
B. 阳极的石墨会与生成的氧气反应生成CO或CO2;
C. CaC12的熔点比CaO低;
D.根据转移电子的物质的量守恒计算得到Ti的质量。
A. Ca还原TiO2的化学方程式为2Ca+TiO2===Ti+2CaO,故A正确;
B. 阳极的石墨会与生成的氧气反应生成CO或CO2,所以石墨质量变小,故B错误;
C. CaC12的熔点比CaO低,所以CaC12的作用可能是增强导电性,同时起到助熔剂的作用,故C正确;
D. 当I=0.5A,通电80分钟,转移电子是物质的量是(0.5×80×60)/ 96500,所以生成钛的质量是(0.5×80×60×48)/4×96500g,故D正确。故选B。

 小题狂做系列答案
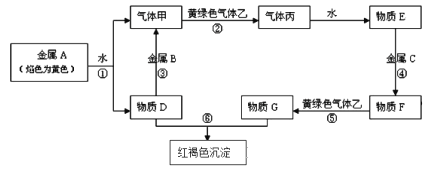
小题狂做系列答案【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.四种金属的活动性强弱顺序为Z>W>Y>X
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置甲中X作原电池正极
D.装置丙中溶液的c(H+)减小
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
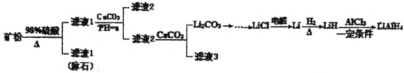
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | A1(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____,“a”的最小值为____。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___;检验碳酸锂是否洗净的实验操作是___。
(3)写出LiH和AlCl3反应的化学方程式:___(条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___。(结果保留2位小数)