题目内容
【题目】在100mL K2CO3与KAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示。下列说法正确的是

A. a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
B. b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
C. c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol·L-1
D. d→e的过程中水的电离程度逐渐减小
【答案】B
【解析】
第一阶段,在100mL K2CO3与KAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,首先发生反应AlO2-+H++H2O═Al(OH)3↓,a点为K2CO3、KCl溶液;
第二阶段,AlO2-反应完毕,开始发生反应CO32-+H+═ HCO3-,b点CO32-、HCO3-的物质的量相等,但是水解程度不同,CO32-水解能力大于HCO3-。由图可知c点CO32-反应完毕,c点为KHCO3、KCl溶液;
第三阶段,cd段:CO32-反应完毕,然后发生反应HCO3-+H+═CO2↑+H2O,由图可知d点HCO3-反应完毕,d点为KCl溶液;
第四阶段,d→e的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,据此进行解答。
A.由分析可知,a点为K2CO3、KCl溶液,根据质子守恒可得:(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故A错误;
B.b点K2CO3和KHCO3的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-),故B正确;
C. c点溶液中:c(Cl-)=![]() =0.5 mol·L-1,c(HCO3-)+c(H2CO3)+c(CO32-)=
=0.5 mol·L-1,c(HCO3-)+c(H2CO3)+c(CO32-)=![]() =0.25 mol·L-1,则c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=0.75 mol·L-1,故C错误;
=0.25 mol·L-1,则c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=0.75 mol·L-1,故C错误;
D.d→e的过程,发生反应Al(OH)3+3H+═Al3++3H2O,Al3+浓度逐渐增大,水的电离程度逐渐增大,故D错误;
答案选B。

【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
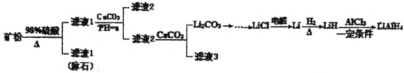
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | A1(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____,“a”的最小值为____。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___;检验碳酸锂是否洗净的实验操作是___。
(3)写出LiH和AlCl3反应的化学方程式:___(条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___。(结果保留2位小数)