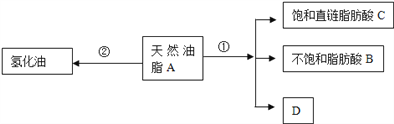
题目内容
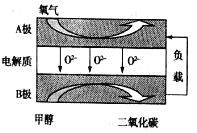
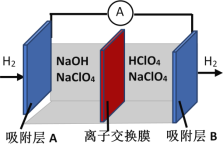
【题目】刚结束的两会《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种正负电极反应均涉及氢气的新型“全氢电池”,能量效率可达80%。下列说法中错误的是
A. 该装置将化学能转换为电能
B. 离子交换膜允许H+和OH-通过
C. 负极为A,其电极反应式是H2-2e- + 2OH- = 2H2O
D. 电池的总反应为H+ + OH-![]() H2O
H2O
【答案】B
【解析】
由工作原理图可知,左边吸附层A上氢气失电子与氢氧根结合生成水,发生了氧化反应为负极,电极反应是H2-2e-+2OH-═2H2O,右边吸附层B为正极,发生了还原反应,电极反应是2H++2e-═H2↑,结合原电池原理分析解答。
A.“全氢电池”工作时是原电池反应,能量变化是将化学能转化为电能,故A正确;
B. 由工作原理图可知,左边溶液为碱性,右边溶液为酸性,所以离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和,因此该离子交换膜不能允许H+和OH-通过,故B错误;
C.根据氢气的进出方向可知,氢气在吸附层A上发生氧化反应,化合价由0价变成+1价,吸附层A为负极,电极反应为:H2-2e-+2OH-═2H2O,故C正确;
D.根据C的分析可知,右边吸附层B为正极,发生了还原反应,正极电极反应是2H++2e-═H2↑,左边吸附层A为负极,发生了氧化反应,电极反应是H2-2e-+2OH-═2H2O,因此总反应为:H++OH-![]() H2O,故D正确;
H2O,故D正确;
答案选B。

练习册系列答案
相关题目