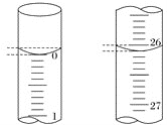
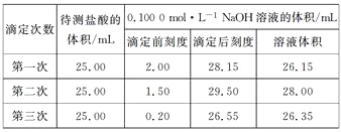
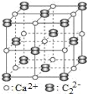
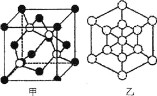
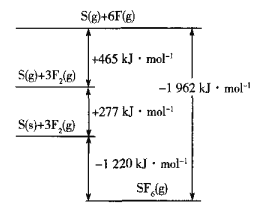
题目内容
【题目】①一种二肽的结构简式为: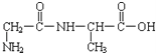 ,合成这种二肽的氨基酸是___和___;
,合成这种二肽的氨基酸是___和___;
②生活中有大量的铝制品。家用铝锅不能用热碱水洗涤去污,原因是(用离子方程式表示)____;
③大量使用塑料制品产生的污染称之为_____,防治该污染的有效措施之一是进行回收利用,将回收后的塑料进行____,可以获得乙烯、丙烯等化工原料;
④传统生产水泥的原料中除了石灰石、粘土外,还经常添加____,以调节水泥的硬化速度。
【答案】甘氨酸 丙氨酸 Al2O3+2OH-=2AlO2-+H2O 白色污染 裂解 石膏
【解析】
①两分子氨基酸脱水形成肽键,利用逆推法判断;
②碳酸钠溶液水解,溶液显碱性;
③大分子烃裂解可生成小分子烯烃;
④石膏可以调节水泥的硬化速度。
①该二肽的结构简式为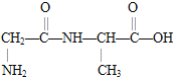 ,断裂肽键,氨基上增加一个氢原子,羰基上增加一个羟基,所以合成这种二肽的氨基酸是
,断裂肽键,氨基上增加一个氢原子,羰基上增加一个羟基,所以合成这种二肽的氨基酸是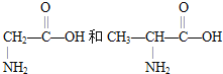 或甘氨酸和丙氨酸;
或甘氨酸和丙氨酸;
②热碱水溶液呈碱性,铝能与碱性物质反应,离子方程式为:Al2O3+2OHˉ=2AlO2ˉ+H2O;
③废弃塑料产生的污染,属于白色污染;塑料主要成分为聚乙烯,可裂解生成乙烯、丙烯;
④传统水泥中经常添加石膏,以调节水泥的硬化速度。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
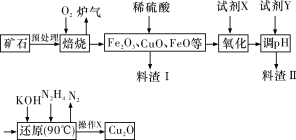
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________(填化学式),Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,则“氧化”反应的离子方程式为____________________,并写出H2O2的电子式:__________;当试剂X是__________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是__________。
(4)操作X包括__________、洗涤、烘干,其中烘干时要隔绝空气,其目的是_________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:____________________________________。
【题目】下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。
| IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | |||||||
3 | ④ | ⑤ | ⑥ | ||||||
请按要求回答下列问题:
(1)元素③的最高价氧化物对应的水化物的化学式为 ;
(2)②、③两元素的原子半径较大的是______________(填元素符号);
(3)④和⑤两种元素的金属性较强的是 (填元素符号);
(4)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 。