题目内容
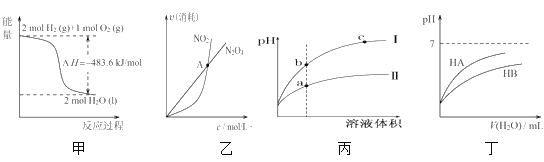
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法错误的是( )
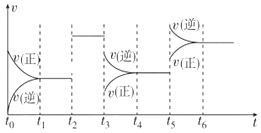
A.t2时加入了催化剂
B.t3时减小了压强
C.t5时升高了温度
D.t4~t5时间内X转化率最低
【答案】D
【解析】
A、t2时刻,改变条件时,正逆反应速率都增大且仍然相等,说明平衡不移动,该反应前后气体计量数之和改变,所以改变的条件只能是催化剂,故A正确;
B、t3时刻,改变条件时,正逆反应速率都减小,且逆反应速率大于正反应速率,平衡逆向移动,该反应的正反应是放热反应,则改变的条件应该是压强,故B正确;
C、t5时刻,改变条件时,正逆反应速率都增大,逆反应速率大于正反应速率,平衡逆向移动,改变的条件应该是升高温度,故C正确;
D、t2时刻平衡不移动,t3、t5时刻平衡逆向移动,所以t6时刻后参加反应的反应物物质的量最少,则反应物的转化率最低,故D错误。
故选D。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】向硝酸酸化的2 mL 0.1 mol·L-1 AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈棕黄色,试管底部仍存在黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行了如下探究。
Ⅰ.探究Fe2+产生的原因。
(1)提出猜想:Fe2+可能是Fe与________或________反应的产物。(均填化学式)
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5 min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液。
液体试剂 | 加入铁氰化 | |
钾溶液 | ||
1号试管 | 2 mL 0.1 mol·L-1 | |
AgNO3溶液 | 无蓝色沉淀 | |
2号试管 | 硝酸酸化的2 mL 0.1 mol·L-1______溶液(pH=2) | 蓝色沉淀 |
①2号试管中所用的试剂为_________。
②资料显示:该温度下,0.1 mol·L-1 AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为_______。
③小组同学继续进行实验,证明了由2号试管得出的结论正确。实验如下:取100 mL 0.1 mol·L-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉并搅拌,分别插入pH传感器和NO![]() 传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
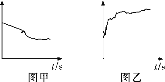
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为__________。
Ⅱ.探究Fe3+产生的原因。
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化了。小组同学设计了不同的实验方案对此进行验证。
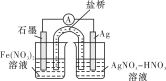
(3)方案一:取出少量黑色固体,洗涤后,______(填操作和现象),证明黑色固体中有Ag。
(4)方案二:按下图连接装置,一段时间后取出左侧烧杯中的溶液,加入KSCN溶液,溶液变红。该实验现象________(填“能”或“不能”)证明Fe2+可被Ag+氧化,理由为________。