题目内容
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图:
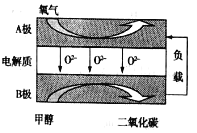
(1)B极为电池______极,B极的电极反应式为______________。
(2)该电池工作时,外电路每流过2mol e-,消耗标况下氧气__________L。
【答案】负 CH3OH+3O2﹣﹣6e﹣=CO2+2H2O 11.2
【解析】
(1)B极加入甲醇,发生氧化反应,为电池的负极;总反应式为2CH3OH+3O2=2CO2+4H2O,正极反应式为:O2+2e-=2O2-,两式相减可得负极电极反应式;
(2)根据电池总反应式分析。
(1)B极加入甲醇,发生氧化反应,为电池的负极;总反应式为:2CH3OH+3O2=2CO2+4H2O,正极反应式为:O2+2e=2O2,两式相减,负极反应为:CH3OH+3O2﹣﹣6e﹣=CO2+2H2O,故答案为:负;CH3OH+3O2﹣﹣6e﹣=CO2+2H2O;
(2)根据电池电极反应式2CH3OH+3O2=2CO2+4H2O知,当消耗3mol O2时,转移12mol电子,因此当电池工作时,外电路每流过2mol e-,消耗标况下氧气0.5mol O2,即消耗标况下氧气11.2L,故答案为:11.2L。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
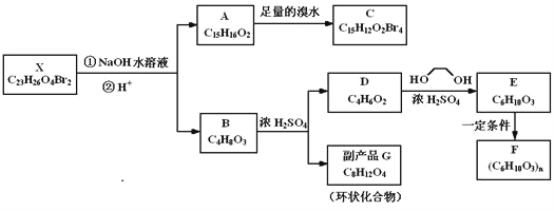
第三学期赢在暑假系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
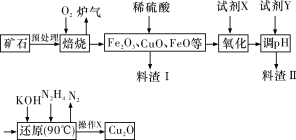
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________(填化学式),Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,则“氧化”反应的离子方程式为____________________,并写出H2O2的电子式:__________;当试剂X是__________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是__________。
(4)操作X包括__________、洗涤、烘干,其中烘干时要隔绝空气,其目的是_________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:____________________________________。
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:
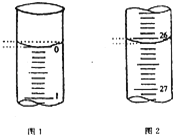
(1)所用盐酸溶液的体积为________mL
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,用酚酞做指示剂,达到滴定终点的现象是:_____
(3)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=_______
(4)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是_______(填写编号)。
A.中和滴定达终点时俯视滴定管内液面读数。
B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定。
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定。
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定。