题目内容
【题目】现有易溶强电解质的混合溶液10L,其中可能含存![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,向其中通入
中的几种,向其中通入![]() 气体,产生沉淀的量与通入
气体,产生沉淀的量与通入![]() 的量之间的关系如图所示,下列说法正确的是( )
的量之间的关系如图所示,下列说法正确的是( )

A.该溶液中能确定存在的离子是![]() 、
、![]() 、
、![]()
B.肯定不存在的离子是![]() 、
、![]()
C.若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L
D.OA段反应的离子方程式:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
【答案】C
【解析】
通入二氧化碳,在OA段产生沉淀,说明一定含Ba2+,根据离子共存条件,一定不含SO42-,因二者反应会生成硫酸钡沉淀;在BC段产生沉淀,说明含AlO2-,AlO2-存在碱性环境,故一定含OH-,不含NH4+,因NH4+与OH-反应放氨气,根据OA段,通入1mol二氧化碳生成1mol沉淀,所以 Ba2+为1mol,反应方程式为:Ba(OH)2+CO2=BaCO3↓+H2O,AB段沉淀不变,说明二氧化碳和OH-反应,结合OA段可知含 OH-共2.5mol,根据BC段可知发生反应:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-,故消耗二氧化碳0.5mol,即AlO2-的物质的量为1mol,CD段发生反应:CO32-+CO2+H2O═2HCO3-,DE段发生反应:BaCO3+CO2+H2O═Ba2++2HCO3-,根据电荷守恒,所含阳离子所带正电荷为Ba2+所带电荷:2mol,阴离子所带负电荷为AlO2-、OH-所带:2.5mol+1mol=3.5mol,故一定还含阳离子,根据电荷守恒,计算出所含阳离子物质的量,进而计算出浓度。
通入二氧化碳,在OA段产生沉淀,说明一定含Ba2+,根据离子共存条件,一定不含SO42-,因二者反应会生成硫酸钡沉淀;在BC段产生沉淀,说明含AlO2-,AlO2-存在碱性环境,故一定含OH-,不含NH4+,因NH4+与OH-反应放氨气,根据OA段,通入1mol二氧化碳生成1mol沉淀,所以 Ba2+为1mol,反应方程式为:Ba(OH)2+CO2=BaCO3↓+H2O,AB段沉淀不变,说明二氧化碳和OH-反应,结合OA段可知含 OH-共2.5mol,根据BC段可知发生反应:2AlO2-+CO2+3H2O═2A l(OH)3↓+CO32-,故消耗二氧化碳0.5mol,即AlO2-的物质的量为1mol,CD段发生反应:CO32-+CO2+H2O═2HCO3-,DE段发生反应:BaCO3+CO2+H2O═Ba2++2HCO3-,根据电荷守恒,所含阳离子所带正电荷为Ba2+所带:2mol,阴离子所带负电荷为AlO2-、OH-所带电荷:2.5mol+1mol=3.5mol,故一定还含阳离子;
A.根据以上分析,该溶液中能确定存在的离子是Ba2+、AlO2-、OH-,故A错误;
B.根据以上分析,该溶液中一定不含:NH4+、Cl-、SO42-,故B错误;
C.不能确定离子中至少还存在一种阳离子存在,所给阳离子中还有K+、Na+没确定,可通过焰色反应来鉴别;根据电荷守恒,所含离子的物质的量设为n,则有:n+2mol=4mol,n=2,浓度为:![]() =0.20mol/L,故C正确;
=0.20mol/L,故C正确;
D.BC段反应的离子方程式:2AlO2-+CO2+3H2O═2A l(OH)3↓+CO32-,故D错误;
故答案为C。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如图该条件下,1molN2和1molO2完全反应生成NO会吸收______kJ能量。

(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请表中数据补充完整:a___________;b___________。
②能验证温度对化学反应速率规律的是实验________![]() 填实验序号
填实验序号![]() 。
。
(3)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) |
|
|
|
|
|
|
①用![]() 表示从0-2s内该反应的平均速率
表示从0-2s内该反应的平均速率![]() ______。
______。
②能说明该反应已达到平衡状态的是______
a.单位时间内消耗nmol![]() 的同时,生成2nmol
的同时,生成2nmol![]()
b.容器内各物质的浓度保持不变
c. 2v逆(NO)=v正(O2)
d.混合气体的总物质的量不随时间的变化而变化
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
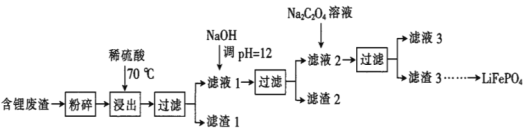
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
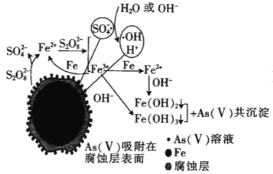
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
【题目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最丰富的元素 |
Y | 植物生长所必需的三种营养元素中,电负性最大的 |
Z | 原子最外层电子数是其电子层数的3倍 |
Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
W | 其+2价阳离子的价电子排布为3d9 |
请回答下列问题:
(1)W元素位于周期表的第___周期___族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___和___;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___。
(3)元素Q的简单离子半径___元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___(用化学式表示)。