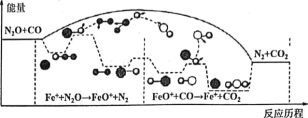
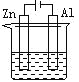
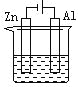
题目内容
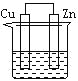
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。下列说法错误的是( )

A.放电过程中右槽溶液颜色逐渐由绿色变为紫色
B.放电过程中氢离子的作用之一是参与正极反应
C.充电过程中左槽溶液逐渐由蓝变黄
D.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol
【答案】A
【解析】
A.根据图示电源的正负极连接方式可得,放电时,右侧电极是负极,发生氧化反应,V2+转化为V3+,溶液由紫色变为绿色,故A错误;
B.根据A项分析,放电时,右侧电极是负极,发生氧化反应,负极反应为:V2+-e-=V3+,左侧为正极,发生还原反应,正极反应为:VO2++2H++e-= VO2++H2O,负极区溶液中的氢离子通过交换膜进入正极区,所以氢离子的作用是参与正极反应和平衡电荷,故B正确;
C.根据A项分析,放电时,右侧电极是负极,发生氧化反应,则充电时,右侧电极是阴极,发生还原反应;放电时,左侧为正极,发生还原反应,充电时,左槽为阳极,发生氧化反应,阳极反应为:VO2++H2O- e-= VO2++2H+,溶液逐渐由蓝变黄,故C正确;
D.根据C项分析,充电时,左槽为阳极,发生氧化反应,阳极反应为:VO2++H2O- e-= VO2++2H+,根据电极反应,转移1mol电子,生成2mol H+,若转移的电子数为3.01×1023个,即转移0.5mol电子,左槽溶液中生成1mol H+,由于H+的作用是平衡电荷,同时有0.5mol H+从左槽移到右槽,所以,左槽溶液中氢离子的物质的量实际增多了0.5mol,故D正确;
答案选A。

练习册系列答案
相关题目