题目内容
【题目】汽车尾气中含有CO、NO等有害气体。
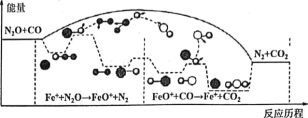
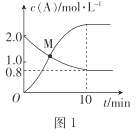
(1)汽车尾气中NO生成过程的能量变化示意图如图该条件下,1molN2和1molO2完全反应生成NO会吸收______kJ能量。

(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请表中数据补充完整:a___________;b___________。
②能验证温度对化学反应速率规律的是实验________![]() 填实验序号
填实验序号![]() 。
。
(3)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) |
|
|
|
|
|
|
①用![]() 表示从0-2s内该反应的平均速率
表示从0-2s内该反应的平均速率![]() ______。
______。
②能说明该反应已达到平衡状态的是______
a.单位时间内消耗nmol![]() 的同时,生成2nmol
的同时,生成2nmol![]()
b.容器内各物质的浓度保持不变
c. 2v逆(NO)=v正(O2)
d.混合气体的总物质的量不随时间的变化而变化
【答案】180 1.2×10-3 5.80×10-3 Ⅰ和Ⅲ 1.5×10-3mol-1L-1s-1 bd
【解析】
(1)N2(g)+O2(g)=2NO(g),根据能量变化图,结合反应热=反应物断键吸收的能量-生成物形成化学键释放出的能量,计算反应热,
(2)①验证温度对化学反应速率的影响,温度要不同,其他条件相同;验证催化剂的比表面积对化学反应速率的影响,要催化剂的比表面积不同,其他条件相同;②验证温度对化学反应速率的影响,温度要不同,其他条件相同;
(3)①先计算一氧化氮的反应速率,再根据同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,计算氧气的反应速率;②当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,据此分析判断。
(1)N2(g)+O2(g)=2NO(g),反应热=反应物断键吸收的能量-生成物形成化学键释放出的能量,该反应的反应热=(946+498)kJ/mol-2×632kJ/mol=+180kJ/mol,说明1molN2和1molO2完全反应生成NO会吸收180kJ的能量,故答案为:180;
(2)①验证温度对化学反应速率的影响,温度要不同,其他条件相同,所以a=1.2×10-3;验证催化剂的比表面积对化学反应速率的影响,要催化剂的比表面积不同,其他条件相同,b=5.80×10-3,故答案为:1.2×10-3;5.80×10-3;
②验证温度对化学反应速率的影响,只有实验Ⅰ和Ⅲ的温度不同,其他条件要相同,故答案为:Ⅰ和Ⅲ;
(3)①0~2s时,v(NO)=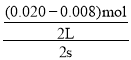 =0.003mol/(L·s),同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=
=0.003mol/(L·s),同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=![]() v(NO)=1.5×10-3molL-1s-1,故答案为:1.5×10-3molL-1s-1;
v(NO)=1.5×10-3molL-1s-1,故答案为:1.5×10-3molL-1s-1;
②a.单位时间内消耗nmolO2的同时,生成2nmolNO2,都表示正反应速率,不能说明达到平衡状态,故a错误;b.容器内各物质的浓度保持不变,可说明达到平衡状态,故b正确;c.2v逆(NO)=v正(O2),表示正、逆反应速率不等,没有达到平衡状态,故c错误;d.该反应恰好气体的物质的量不等,混合气体的总物质的量不随时间的变化而变化,可说明达到平衡状态,故d正确;故答案为:bd。

【题目】二甲醚主要用于替代汽车燃油、制氢及用于燃料电池原料。 回答下列问题
⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反应速率为__________________ 。
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为______,负极的电极反应式为 ____。

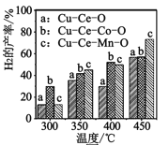
⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2 产率与催化剂及温度下关系如下图 所示,适宜的催化剂是______(选填 a、b、c)及适宜的温度是____ 。
⑷工业中用 CO 和 H2 为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g) CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。
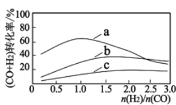
①最佳 n(H2)/n(CO)比为_________________ (填图中数字)。
②同一温度下,CO(g)+H2O(g) CO2(g)+H2(g)平衡常数为 K3,则 K3=__________用含 K1、K2 代数式表示)。
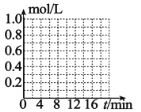
⑸已知反应 CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2 转化率为 75%,在下图中 画出 CO2 和 CH3OH(g)的浓度随时间变化曲线________。
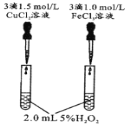
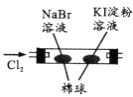
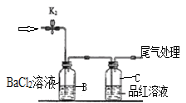
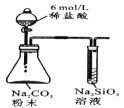
【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3 和SO2 | 非金属性:C>Si |
A.AB.BC.CD.D