题目内容
19.金属镍及其化合物在合金材料以及催化剂等方面用广泛.(1)基态镍原子的外围电子排布式为3d84s2.
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学N2、CN-.
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为LaNi5.
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图2所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.

分析 (1)Ni原子核外有28个电子,Ni原子3d、4s能级电子为其外围电子,根据构造原理书写基态镍原子的外围电子排布式;
(2)原子个数相等、价电子数相等的微粒互为等电子体;
(3)根据价层电子对互斥理论判断原子杂化方式、微粒空间构型;
(4)该晶胞中La原子个数=8×$\frac{1}{8}$=1、Ni原子个数=1+8×$\frac{1}{2}$=5,La、Ni原子个数之比=1:5;
(5)配位键由含有孤电子对的原子指向含有空轨道的原子;
该配合物中N-O中O原子和-OH中氢原子形成氢键.
解答 解:(1)Ni原子核外有28个电子,Ni原子3d、4s能级电子为其外围电子,根据构造原理知基态镍原子的外围电子排布式为3d84s2,故答案为:3d84s2;
(2)原子个数相等、价电子数相等的微粒互为等电子体,CO分子中原子个数是2、价电子数是14,与CO互为等电子体的分子、离子有N2、CN-,故答案为:N2;CN-;
(3)①CH2=CH2中每个C原子价层电子对个数是3且不含孤电子对,为sp2杂化;
②HC≡CH中每个C原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;
③ 中每个C原子价层电子对个数是3且不含孤电子对,所以为sp2杂化;
中每个C原子价层电子对个数是3且不含孤电子对,所以为sp2杂化;
④HCHO中C原子价层电子对个数是3且不含孤电子对,为sp2杂化,平面三角形结构,碳原子采取sp2杂化的分子有①③④,
故答案为:①③④;平面三角;
(4)该晶胞中La原子个数=8×$\frac{1}{8}$=1、Ni原子个数=1+8×$\frac{1}{2}$=5,La、Ni原子个数之比=1:5,所以其化学式为LaNi5,故答案为:LaNi5;
(5)配位键由含有孤电子对的原子指向含有空轨道的原子,Ni含有空轨道、N原子含有孤电子对,所以配位键由N原子指向Ni原子;
该配合物中N-O中O原子和-OH中氢原子形成氢键,该配合物分子中配位键、氢键为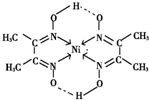 ,
,
故答案为: .
.
点评 本题考查物质结构和性质,涉及晶胞计算、氢键、配位键、原子杂化方式判断等知识点,这些都是高频考点,难点是晶胞计算,易错点是配位键和氢键表示方法.

 阅读快车系列答案
阅读快车系列答案| A. | H2O2的电子式: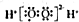 | B. | 硫离子的结构示意图为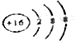 | ||
| C. | 二氧化碳的结构式:O=C=O | D. | CH4分子的比例模型: |
| A. | 对稀土元素及化合物的研究是获得优良催化剂的一种重要途径 | |
| B. | 油脂是人体中热值最高的营养物质,在工业上可用于制肥皂和油漆 | |
| C. | 离子键、共价键和氢键等化学键都可能对物质的熔沸点产生影响 | |
| D. | 高分子膜在分离提纯、物质制备以及能量转化等领域都有广泛应用 |
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3为三角锥形,甲烷是正四面体形 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较弱 | |
| D. | NH3和CH4都是sp3型杂化,键角都是109°28′ |
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va :Vb=11:9 |
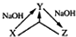 化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )
化学之“化”,体现在物质之间的相互转化,用X表示下列物质,其中在溶液中不可能实现如图转化关系的是( )| A. | AlCl3 | B. | CO2 | C. | SiO2 | D. | H2S |

| A. | 原子序数是15 | B. | 它是非金属元素 | ||
| C. | 磷原子最外层有5个电子 | D. | 磷元素在地壳中的含量为30.97% |